RESUMO
Racional :
A terapia de conversão no câncer gástrico (CG) é definida como o uso de quimio/radioterapia seguida de ressecção cirúrgica com intenção curativa de um tumor que era considerado irressecável ou oncologicamente incurável.
Objetivo :
Avaliar os resultados da terapia de conversão no tratamento do CG.
Métodos :
Análise retrospectiva de todas as operações de CG entre 2009 e 2018. Os pacientes que receberam alguma terapia antes da operação foram também identificados para definir o grupo de conversão.
Resultados :
Entre 1003 operações realizadas para o CG, 113 foram submetidos ao tratamento neoadjuvante e 16 (1,6%) considerados como terapia de conversão. As principais indicações para o tratamento foram: lesões T4b (n=10), metástase linfonodal (n=4), carcinomatose peritoneal e metástase hepática em 1 caso cada. O diagnóstico foi feito por exame de imagem em 14 casos (75%) e durante o procedimento cirúrgico em 4 casos (25%). Os esquemas quimioterápicos mais utilizados foram XP e mFLOX. Complicações cirúrgicas maiores ocorreram em 4 casos (25%) e 1 (6,3%) foi a óbito. Após seguimento médio de 20 meses, 11 pacientes (68,7%) apresentaram recidiva e 9 (56,3%) morreram. Sobrevida livre de recidiva prolongada acima de 40 meses ocorreu em dois casos.
Conclusão :
A terapia de conversão pode oferecer possibilidade de sobrevida prolongada para um grupo de pacientes com CG considerados inicialmente fora das possibilidades terapêuticas.
DESCRITORES:
Neoplasias gástricas; Terapia neoadjuvante; Gastrectomia
ABSTRACT
Background:
Conversion therapy in gastric cancer (GC) is defined as the use of chemotherapy/radiotherapy followed by surgical resection with curative intent of a tumor that was prior considered unresectable or oncologically incurable.
Aim:
To evaluate the results of conversion therapy in the treatment of GC.
Methods:
Retrospective analysis of all GC surgeries between 2009 and 2018. Patients who received any therapy before surgery were further identified to define the conversion group.
Results:
Out of 1003 surgeries performed for GC, 113 cases underwent neoadjuvant treatment and 16 (1.6%) were considered as conversion therapy. The main indication for treatment was: T4b lesions (n=10), lymph node metastasis (n=4), peritoneal carcinomatosis and hepatic metastasis in one case each. The diagnosis was made by imaging in 14 cases (75%) and during surgical procedure in four (25%). The most commonly used chemotherapy regimens were XP and mFLOX. Major surgical complications occurred in four cases (25%) and one (6.3%) died. After an average follow-up of 20 months, 11 patients (68.7%) had recurrence and nine (56.3%) died. Prolonged recurrence-free survival over 40 months occurred in two cases.
Conclusion:
Conversion therapy may offer the possibility of prolonged survival for a group of GC patients initially considered beyond therapeutic possibility.
HEADINGS:
Stomach neoplasms; Neoadjuvant therapy; Gastrectomy
INTRODUÇÃO
O câncer gástrico (CG) é o quinto câncer mais comum no mundo. Estima-se que quase um milhão (952.000) de novos casos tenham ocorrido em todo o mundo em 20121111 Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012, International journal of cancer, 2015 Mar 01;136(5):E359-86,. A cirurgia permanece como a principal opção de tratamento curativo, e a gastrectomia com linfadenectomia D2 é considerada o tratamento cirúrgico padrão para o CG localmente avançado. Infelizmente, muitos pacientes no momento do diagnóstico já apresentam tumores localmente irressecáveis ou sinais de doença sistêmica2222 Pereira MA, Ramos MFKP, Dias AR, Yagi OK, Faraj SF, Zilberstein B, et al. Detection of occult lymph node tumor cells in node-negative gastric cancer patients, Arquivos brasileiros de cirurgia digestiva:ABCD, Brazilian archives of digestive surgery, 2017 Jan-Mar;30(1):30-4,. Para os pacientes em estágio clínico (EC) IV, a quimioterapia (QT) paliativa representa o padrão atual de tratamento1818 Japanese Gastric Cancer A. Japanese gastric cancer treatment guidelines 2014 (ver, 4), Gastric Cancer 2017;20:1-19,.
Recentemente, a terapia de conversão surgiu como uma nova possibilidade de tratamento para esses pacientes2626 Yoshida K, Yamaguchi K, Okumura N, Tanahashi T, Kodera Y. Is conversion therapy possible in stage IV gastric cancer: the proposal of new biological categories of classification, Gastric cancer : official journal of the International Gastric Cancer Association and the Japanese Gastric Cancer Association, 2016 Apr;19(2):329-38,. Ela consiste na administração de quimioterapia seguida de cirurgia em pacientes com CG ECIV. É também descrita como a combinação de quimioterapia de indução e cirurgia “adjuvante”. Essa opção pode ser indicada para tratar lesões irressecáveis ou marginalmente ressecáveis, pacientes com metástase linfonodal (LNM) à distância ou mesmo aqueles com doença metastática ou disseminação peritoneal. Nos últimos anos, o desenvolvimento e aprimoramento de esquemas quimioterápicos e a terapia-alvo baseada em marcadores moleculares têm melhorado dramaticamente as taxas de resposta22 Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial, Lancet (London, England), 2010 Aug 28;376(9742):687-97,,66 Cutsem EV, Moiseyenko VM, Tjulandin S, Majlis A, Constenla M, Boni C, et al. Phase III Study of Docetaxel and Cisplatin Plus Fluorouracil Compared With Cisplatin and Fluorouracil As First-Line Therapy for Advanced Gastric Cancer: A Report of the V325 Study Group, Journal of Clinical Oncology, 2006;24(31):4991-7,. Assim, tornou-se cada vez mais comum para os cirurgiões reavaliarem pacientes inicialmente rotulados como não candidatos à ressecção curativa que apresentam uma doença completamente diferente após a quimioterapia paliativa/conversão inicial. Esse novo cenário deu a terapia de conversão grande destaque nas discussões atuais sobre o tratamento do CG. No entanto, o valor clínico dessa estratégia multimodal para o CG em ECIV permanece controverso, com poucos relatos em países ocidentais e definições muito conflitantes de seu uso, o que pode prejudicar uma análise clara de seus resultados.
Assim, o objetivo deste estudo foi analisar os resultados de pacientes que foram submetidos à terapia de conversão em nossa instituição.
MÉTODOS
O estudo foi aprovado pelo comitê de ética do hospital (NP993/16) e registrado on-line (www.plataformabrasil.com; CAAE: 2915516.2.0000.0065).
A partir de revisão de banco de dados prospectivo, foram selecionados todos os pacientes submetidos a qualquer procedimento cirúrgico por adenocarcinoma gástrico de 2008 a 2018. Posteriormente, os pacientes que receberam QT ou radioterapia (RDT) seguida de ressecção gástrica foram incluídos. A terapia de conversão foi definida como pacientes que foram considerados irressecáveis ou marginalmente ressecáveis e/ou com doença disseminada durante o estadiamento inicial e encaminhados para quimioterapia inicial e/ou radioterapia. Aqueles que tiveram resposta parcial ou completa na reavaliação foram indicados para cirurgia e considerados como o grupo de terapia de conversão.
Os pacientes foram submetidos ao estadiamento pré-operatório por meio de tomografia computadorizada de abdome e pelve, endoscopia e exames laboratoriais. A extensão da ressecção gástrica (total x subtotal) foi baseada na localização do tumor para obtenção de margem proximal livre2727 Zilberstein B, Malheiros C, Lourenco LG, Kassab P, Jacob CE, Weston AC, et al. Brazilian consensus in gastric cancer: guidelines for gastric cancer in Brazil, Arquivos brasileiros de cirurgia digestiva : ABCD = Brazilian archives of digestive surgery, 2013 Jan-Mar;26(1):2-6,. O estadiamento TNM foi realizado de acordo com a 7ª edição do TNM2424 Washington K. 7th edition of the AJCC cancer staging manual: stomach, Annals of surgical oncology, 2010 Dec;17(12):3077-9,. Entre as características clínicas avaliadas, incluíram-se: classificação da American Society of Anesthesiologists (ASA)88 Doyle DJ, Garmon EH; American Society of Anesthesiologists Classification (ASA Class). StatPearls, Treasure Island FL: StatPearls Publishing LLC,; 2017,, Índice de Comorbidade de Charlson (CCI)44 Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation, Journal of chronic diseases, 1987;40(5):373-83, e exames laboratoriais. O CCI foi considerado sem inclusão do CG como comorbidade. As complicações cirúrgicas foram graduadas de acordo com a classificação de Clavien-Dindo77 Dindo D, Demartines N, Clavien P-A. Classification of Surgical Complications: A New Proposal With Evaluation in a Cohort of 6336 Patients and Results of a Survey, Annals of surgery, 2004;240(2):205-13,. Complicações maiores foram consideradas Clavien III-V. O tempo de permanência hospitalar e o número de linfonodos recuperados foram avaliados. A mortalidade cirúrgica foi considerada quando ocorrida nos primeiros 30 dias após a cirurgia ou durante a internação hospitalar após o procedimento.
O seguimento pós-operatório foi realizado trimestralmente no primeiro ano e a cada seis meses nos anos seguintes. Os exames de acompanhamento para detecção de recidiva foram realizados com base na presença de sintomas. Ausência em consultas por mais de 12 meses foi considerada como perda de seguimento. Todos os casos foram operados em um centro de alto volume por cirurgiões especializados. A técnica cirúrgica, a extensão da ressecção e as cadeias linfonodais dissecadas seguiram as recomendações das diretrizes da Japanese Gastric Cancer Association1818 Japanese Gastric Cancer A. Japanese gastric cancer treatment guidelines 2014 (ver, 4), Gastric Cancer 2017;20:1-19,.
Análise estatística
O teste do chi-quadrado foi utilizado para variáveis categóricas e teste t para variáveis contínuas. Sobrevida global (SG) e sobrevida livre de doença (SLD) foram estimadas usando o método de Kaplan-Meier, e as diferenças de sobrevivência foram examinadas usando o log rank test. O tempo de sobrevida, em meses, foi calculado a partir da data da cirurgia até a data do óbito e/recidiva. Os pacientes vivos foram censurados na data do último contato. Todos os testes foram bicaudais e p <0,05 foi considerado estatisticamente significativo. A análise foi realizada utilizando o software SPSS, versão 18.0 (SPSS Inc, Chicago, IL).
RESULTADOS
Dos 1.003 pacientes com CG operados no período, a ressecção cirúrgica com intenção curativa foi realizada em 629 casos e procedimentos paliativos em 230. Um total de 113 pacientes foi ressecado com intenção curativa após administração de quimioterapia e/ou radioterapia. Destes, 16 foram considerados como tendo sido submetidos a terapia de conversão (1,6%).
A Tabela 1 apresenta as características clinicopatológicas dos pacientes do grupo de conversão. A maioria dos pacientes apresentou menor classificação de ASA (I - II) e baixo CCI (0-1). Os tumores localizavam-se principalmente na parte distal do estômago (56,3%), sendo o adenocarcinoma intestinal o subtipo histológico mais comum (43,8%). A decisão para definição do caso como candidato a terapia de conversão baseou-se principalmente em exames radiológicos (75%) e 4 pacientes (25%) foram considerados irressecáveis/incuráveis durante procedimento cirúrgico. Os regimes quimioterápicos variaram, com predomínio de esquemas baseados na combinação de platina e fluoropirimidina.
Na Tabela 2 são apresentados os resultados cirúrgicos. A ressecção combinada de outros órgãos foi realizada em 9 casos (56,3%) e em 4 deles mais de um órgão adjacente foi ressecado. Fígado e pâncreas foram ressecados em 5 casos e baço e cólon em 4 casos. A ressecção R0 foi obtida em 13 casos (81,3%). A categoria ypT4 ocorreu em 8 pacientes (50%), o número médio de linfonodos dissecados foi de 35,5 e 4 pacientes (25%) não apresentaram LNM. Apenas 2 pacientes eram EC patológico final IV. Quatro pacientes (25%) tiveram complicações cirúrgicas graves e 1 morreu (6,3%).
O tempo mediano de seguimento foi de 8,9 meses (média=16,2; desvio-padrão=22,3). Onze pacientes (68,8%) tiveram recidiva da doença e 9 (56,3%) foram a óbito. Dois pacientes apresentaram destacada longa sobrevida sem sinal de recorrência: o primeiro caso apresentava inicialmente invasão local do pâncreas e fígado; e o outro caso tinha invasão do pâncreas, duodeno e fístula gastrocutânea devido à invasão da parede abdominal. As características dos pacientes e os resultados de sobrevida são demonstrados na Tabela 3.
A análise de sobrevida, de acordo com o estádio clínico, de todos os 1003 pacientes com CG submetidos a qualquer procedimento cirúrgico demonstrou que, a SG do grupo de conversão foi maior do que nos pacientes ECIV não submetidos à terapia de conversão (43,8% vs. 27%; p=0,037; Figura 1), A mediana de SG para o ECIV foi de 7 meses em comparação com 11,3 meses do grupo conversão. Além disso, não houve diferenças significativas nas taxas de sobrevida entre os pacientes com ECIII (52,3%; SG mediana=27 meses) e o grupo de conversão (p=0,222).
Sobrevida global de acordo com o estádio clínico comparado ao grupo Conversão - método de Kaplan-Meier
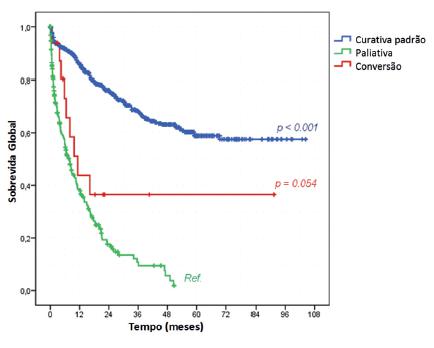
Em relação à sobrevida e à intenção do procedimento cirúrgico realizado, os pacientes submetidos à terapia de conversão apresentaram tendência a melhor SG do que os submetidos a procedimentos paliativos (43,8% vs. 27,9%; p=0,054; Figura 2). A SG mediana foi de 11,3 e 7,9 meses para o grupo de conversão e paliativo, respectivamente. O grupo de tratamento curativo padrão apresentou taxa de sobrevida significativamente maior do que os pacientes paliativos (serviu como grupo de referência), com taxa de SG de 73,2% (p<0,001).
Curva de sobrevida de acordo com a indicação do tratamento cirúrgico - método de Kaplan-Meier
DISCUSSÃO
A terapia de conversão é uma tentativa de transformar uma doença incurável ou irressecável/marginalmente ressecável em curável. O conceito e a definição são frequentemente misturados e confundidos com outras indicações e objetivos no tratamento do CG, especialmente com a QT neoadjuvante. Apesar de também ser administrada antes da cirurgia, a QT neoadjuvante é indicada para tumores que são ressecáveis de princípio, com o objetivo de reduzir a lesão, reduzir a possibilidade de LNM e micrometástases a fim de melhorar a sobrevida, A cirurgia paliativa é indicada com base na presença de sintomas, principalmente sangramento e obstrução1414 Hartgrink HH, Putter H, Klein Kranenbarg E, Bonenkamp JJ, van de Velde CJ. Value of palliative resection in gastric cancer, The British journal of surgery, 2002 Nov;89(11):1438-43,. A cirurgia citorredutora é a ressecção de um paciente assintomático com doença disseminada1212 Fujitani K, Yang H-K, Mizusawa J, Kim Y-W, Terashima M, Han S-U, et al. Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single non-curable factor (REGATTA): a phase 3, randomised controlled trial, The Lancet Oncology, 2016;17(3):309-18,. Tanto a cirurgia citorredutora quanto a paliativo não tem a intenção de curar, mas sim de melhorar a qualidade de vida e prolongar a sobrevida. Os resultados recentes do estudo REGATTA sugerem que, em pacientes metastáticos, a cirurgia citorredutora sem QT prévia não oferece benefício na sobrevida em comparação com a QT paliativa1212 Fujitani K, Yang H-K, Mizusawa J, Kim Y-W, Terashima M, Han S-U, et al. Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single non-curable factor (REGATTA): a phase 3, randomised controlled trial, The Lancet Oncology, 2016;17(3):309-18,. A cirurgia de resgate é o procedimento indicado devido à recorrência do tumor após QT/RDT definitiva. Ela está principalmente relacionada a tumores esofágicos2121 Nakamura T, Hayashi K, Ota M, Eguchi R, Ide H, Takasaki K, et al. Salvage esophagectomy after definitive chemotherapy and radiotherapy for advanced esophageal cancer, American journal of surgery, 2004 Sep;188(3):261-6,.
Parece claro que a terapia de conversão pode ter características de todas essas definições, mas o objetivo principal é conseguir uma ressecção R0 e a cura de pacientes que antes eram considerados incuráveis. No entanto, algumas controvérsias a respeito de sua definição ainda persistem. Alguns consideram como terapia de conversão qualquer gastrectomia realizada após QT paliativa prévia para um CG irressecável1919 Kinoshita J, Fushida S, Tsukada T, Oyama K, Okamoto K, Makino I, et al. Efficacy of conversion gastrectomy following docetaxel, cisplatin, and S-1 therapy in potentially resectable stage IV gastric cancer, European journal of surgical oncology : the journal of the European Society of Surgical Oncology and the British Association of Surgical Oncology, 2015 Oct;41(10):1354-60,,2020 Morgagni P, Solaini L, Framarini M, Vittimberga G, Gardini A, Tringali D, et al. Conversion surgery for gastric cancer: A cohort study from a western center, International journal of surgery (London, England), 2018 May;53:360-5,. Além disso, LNM à distância na maioria das vezes não são tecnicamente irressecáveis, mas também podem ser incluídos no grupo de conversão, de maneira similar ao presente estudo99 Einama T, Abe H, Shichi S, Matsui H, Kanazawa R, Shibuya K, et al. Long-term survival and prognosis associated with conversion surgery in patients with metastatic gastric cancer, Molecular and clinical oncology, 2017 Feb;6(2):163-6,,2020 Morgagni P, Solaini L, Framarini M, Vittimberga G, Gardini A, Tringali D, et al. Conversion surgery for gastric cancer: A cohort study from a western center, International journal of surgery (London, England), 2018 May;53:360-5,. Também é extremamente difícil definir o que é um tumor marginalmente ressecável ou até mesmo irressecável, e isso varia muito, mesmo entre os cirurgiões. Essa falta de uma definição padronizada torna difícil a comparação entre estudos.
Fomos capazes de identificar 16 pacientes que se encaixavam nos critérios de terapia de conversão. Os pacientes eram mais jovens e com menos comorbidades (a maioria deles era ASA I-II com CCI de 0-1) do que relatos anteriores de nossa instituição2323 Ramos MFKP, Pereira MA, Barchi LC, Yagi OK, Dias AR, Szor DJ, et al. Duodenal fistula: The most lethal surgical complication in a case series of radical gastrectomy, International journal of surgery (London, England), 2018 Apr 10;53:366-70,. Isso reflete a capacidade de pacientes mais jovens e saudáveis de suportar as adversidades da QT, otimizando seus resultados para permitir a ressecção cirúrgica. Complicações cirúrgicas maiores ocorreram em 25% dos casos, com 1 óbito cirúrgico. De fato, esperávamos uma maior taxa de morbimortalidade devido à complexidade desses procedimentos cirúrgicos, com 9 casos tendo ressecção combinada de outros órgãos2323 Ramos MFKP, Pereira MA, Barchi LC, Yagi OK, Dias AR, Szor DJ, et al. Duodenal fistula: The most lethal surgical complication in a case series of radical gastrectomy, International journal of surgery (London, England), 2018 Apr 10;53:366-70,.
Segundo Yoshida et al,2626 Yoshida K, Yamaguchi K, Okumura N, Tanahashi T, Kodera Y. Is conversion therapy possible in stage IV gastric cancer: the proposal of new biological categories of classification, Gastric cancer : official journal of the International Gastric Cancer Association and the Japanese Gastric Cancer Association, 2016 Apr;19(2):329-38,, os pacientes do ECIV podem ser divididos em 4 grupos. A divisão é baseada na presença de doença peritoneal, metástase sistêmica, metástase linfonodal e ressecabilidade do tumor. Os tumores do tipo 1 são definidos oncologicamente como tumores ECIV, mas com metástases tecnicamente ressecáveis sem a necessidade de qualquer regime de quimioterapia para o downstage do tumor. Estão relacionados principalmente a metástase hepática única, citologia peritoneal positiva e LNM à distância. Nesse grupo, a administração de QT antes da cirurgia pode até ser considerada neoadjuvante. Como esta situação não é comum, nós a consideramos como terapia de conversão em nossa análise. Os tumores tipo 2 têm mais de duas metástases hepáticas, LNM distante ou lesão primária maior que 5 cm localizada próxima à veia porta e/ou artéria hepática.
Os pacientes com disseminação peritoneal (tipos 3 e 4) são considerados como os de pior prognóstico. No presente estudo, apenas 1 caso com metástase peritoneal foi operado com desfecho desfavorável. Esse resultado ruim também é relatado por outros autores99 Einama T, Abe H, Shichi S, Matsui H, Kanazawa R, Shibuya K, et al. Long-term survival and prognosis associated with conversion surgery in patients with metastatic gastric cancer, Molecular and clinical oncology, 2017 Feb;6(2):163-6,,2525 Yamaguchi K, Yoshida K, Tanahashi T, Takahashi T, Matsuhashi N, Tanaka Y, et al. The long-term survival of stage IV gastric cancer patients with conversion therapy, Gastric cancer : official journal of the International Gastric Cancer Association and the Japanese Gastric Cancer Association, 2018 Mar;21(2):315-23,. Deve-se ressaltar que não adicionou-se nenhum tipo de QT peritoneal ao procedimento. Recentemente, o uso de QT peritoneal e HIPEC tem sido empregado na tentativa de melhorar os resultados nessa população33 Chan DY, Syn NL, Yap R, Phua JN, Soh TI, Chee CE, et al. Conversion Surgery Post-Intraperitoneal Paclitaxel and Systemic Chemotherapy for Gastric Cancer Carcinomatosis Peritonei, Are We Ready? Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract, 2017 Mar;21(3):425-33,. Até o momento, não há evidências definitivas de sua efetividade, entretanto seu uso pode aumentar a indicação e o número de casos candidatos à terapia de conversão11 Badgwell B, Blum M, Das P, Estrella J, Wang X, Ho L, et al. Phase II Trial of Laparoscopic Hyperthermic Intraperitoneal Chemoperfusion for Peritoneal Carcinomatosis or Positive Peritoneal Cytology in Patients with Gastric Adenocarcinoma, Annals of surgical oncology, 2017 Oct;24(11):3338-44,,1717 Ishigami H, Kitayama J, Kaisaki S, Hidemura A, Kato M, Otani K, et al. Phase II study of weekly intravenous and intraperitoneal paclitaxel combined with S-1 for advanced gastric cancer with peritoneal metastasis, Annals of oncology : official journal of the European Society for Medical Oncology, 2010 Jan;21(1):67-70,.
Dois casos apresentaram resultados favoráveis em longo prazo com SG maior que 40 meses. Ambos foram considerados marginalmente ressecáveis devido a tumores localmente avançados (Yoshida tipo 2). As curvas de SG de acordo com o EC demonstraram leve melhora com a terapia de conversão em relação aos outros tumores ECIV durante os 2 primeiros anos de seguimento. No entanto, como só temos 16 casos de terapia de conversão, esses 2 casos com sobrevida em longo prazo têm um efeito importante na curva de sobrevida, a ponto de após 2 anos, a curva inclusive cruzar a do ECIII. O mesmo efeito ocorre na curva de sobrevida de acordo com a intenção do tratamento cirúrgico adotada. Apesar da significância estatística encontrada, é possível perceber que o ponto chave é descobrir qual paciente apresentará sobrevivência em longo prazo. Caso contrário, a evolução dos pacientes submetidos a terapia de conversão é apenas um pouco melhor do que os outros pacientes com ECIV ou submetidos a procedimentos paliativos.
Os tumores marginalmente ressecáveis são provavelmente a indicação mais favorável para a terapia de conversão. No entanto, sua definição carrega um alto risco de viés de classificação. O que é um tumor marginalmente ressecável? Um claro consenso na definição ainda é necessário. Mesmo para o câncer de pâncreas, que há muito tempo usa o termo marginalmente ressecável, existem diferentes definições1616 Isaji S, Mizuno S, Windsor JA, Bassi C, Fernandez-Del Castillo C, Hackert T, et al. International consensus on definition and criteria of borderline resectable pancreatic ductal adenocarcinoma 2017, Pancreatology : official journal of the International Association of Pancreatology (IAP) [et al], 2018 Jan;18(1):2-11,. Assim, a inclusão de tumores “limítrofes” para ressecção no grupo de terapia de conversão pode erroneamente melhorar seus resultados. Além disso, os resultados da terapia neoadjuvante também podem ser falsamente melhorados com a transferência desses pacientes “limítrofes” para o grupo de terapia de conversão. Isso deve ser levado em consideração visto que a maioria dos estudos relacionados à terapia de conversão é retrospectivo. Portanto, para amenizar esse viés, a definição do objetivo de QT pré-operatória, se neoadjuvante ou conversão, deve ser definida e relatada antes do início do tratamento.
Diferentes regimes de quimioterapia foram realizados em nosso estudo. Isso reflete as diferentes perspectivas dos pacientes quando eles iniciaram a QT paliativa. A análise de um período de 9 anos também desempenha um papel importante na variedade de regimes adotados. A cisplatina, oxaliplatina, bem como o 5-fluorouracil e a capecitabina, já demonstraram serem igualmente eficazes na doença avançada55 Cunningham D, Starling N, Rao S, Iveson T, Nicolson M, Coxon F, et al. Capecitabine and Oxaliplatin for Advanced Esophagogastric Cancer, New England Journal of Medicine, 2008;358(1):36-46,. A cisplatina e a combinação com irinotecano demonstraram eficácia em um ensaio de fase II com braço único1515 Ilson DH, Saltz L, Enzinger P, Huang Y, Kornblith A, Gollub M, et al. Phase II Trial of Weekly Irinotecan Plus Cisplatin in Advanced Esophageal Cancer, Journal of Clinical Oncology, 1999;17(10):3270-5,, embora isso pareça ser inferior à combinação de platina e fluoropirimidina em um estudo de fase 2 randomizado1010 Enzinger PC, Burtness BA, Niedzwiecki D, Ye X, Douglas K, Ilson DH, et al. CALGB 80403 (Alliance)/E1206: A Randomized Phase II Study of Three Chemotherapy Regimens Plus Cetuximab in Metastatic Esophageal and Gastroesophageal Junction Cancers, Journal of Clinical Oncology, 2016 07/05;34(23):2736-42,. Visto que existem várias combinações possíveis, muitos fatores devem ser levados em conta ao escolher o esqueleto de quimioterapia: comorbidades, status de desempenho, disponibilidade de bomba de infusão, capacidade de engolir comprimidos, disponibilidade para chegar ao centro para tratamento.
Uma das principais limitações deste estudo é o pequeno número de pacientes incluídos. Além disso, não é possível quantificar o total de pacientes que foram submetidos ao tratamento paliativo e que poderiam ser considerados candidatos à conversão. Portanto, a taxa de pacientes que completaram com sucesso a terapia de conversão é desconhecida, determinando um viés de seleção relevante. Estudos anteriores relataram taxas entre 26 e 32,4% 1313 Fukuchi M, Ishiguro T, Ogata K, Suzuki O, Kumagai Y, Ishibashi K, et al. Prognostic Role of Conversion Surgery for Unresectable Gastric Cancer, Annals of surgical oncology, 2015 Oct;22(11):3618-24,,2020 Morgagni P, Solaini L, Framarini M, Vittimberga G, Gardini A, Tringali D, et al. Conversion surgery for gastric cancer: A cohort study from a western center, International journal of surgery (London, England), 2018 May;53:360-5,,2525 Yamaguchi K, Yoshida K, Tanahashi T, Takahashi T, Matsuhashi N, Tanaka Y, et al. The long-term survival of stage IV gastric cancer patients with conversion therapy, Gastric cancer : official journal of the International Gastric Cancer Association and the Japanese Gastric Cancer Association, 2018 Mar;21(2):315-23,. Estudos prospectivos com critérios claros de inclusão/exclusão são necessários para responder a essa questão. Recentemente, um protocolo de terapia de conversão foi desenvolvido em nossa instituição para abordar essa questão. Outra limitação é que nosso grupo paliativo, utilizado na comparação da análise de sobrevida, é formado apenas por pacientes submetidos a procedimentos paliativos cirúrgicos devido à presença de sintomas. Pacientes assintomáticos que receberam QT paliativa exclusiva não foram incluídos na análise.
Em resumo, nossos resultados sugerem que a terapia de conversão deve ser considerada com cautela. O racional desta modalidade terapêutica e os relatos de bons resultados clínicos nesses pacientes com perspectivas limitadas encorajam sua pronta adoção. No entanto, dados definitivos para corroborar sua efetividade e definir os melhores candidatos ainda são necessários. Como o número de pacientes candidatos para essa terapia é muito pequeno para realizar um ensaio clínico prospectivo randomizado, o relatório da série de casos, como o presente estudo, representa a opção atual para análise e coleta de dados.
CONCLUSÃO
A terapia de conversão pode oferecer a possibilidade de ressecção cirúrgica com sobrevida em longo prazo para um grupo de pacientes considerados inicialmente fora das possibilidades terapêuticas. Entretanto, definições quanto ao melhor esquema terapêutico, critérios diagnósticos de irressecabilidade e qual grupo de pacientes se beneficiariam dessa modalidade ainda são necessárias.
REFERENCES
-
1Badgwell B, Blum M, Das P, Estrella J, Wang X, Ho L, et al. Phase II Trial of Laparoscopic Hyperthermic Intraperitoneal Chemoperfusion for Peritoneal Carcinomatosis or Positive Peritoneal Cytology in Patients with Gastric Adenocarcinoma, Annals of surgical oncology, 2017 Oct;24(11):3338-44,
-
2Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial, Lancet (London, England), 2010 Aug 28;376(9742):687-97,
-
3Chan DY, Syn NL, Yap R, Phua JN, Soh TI, Chee CE, et al. Conversion Surgery Post-Intraperitoneal Paclitaxel and Systemic Chemotherapy for Gastric Cancer Carcinomatosis Peritonei, Are We Ready? Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract, 2017 Mar;21(3):425-33,
-
4Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation, Journal of chronic diseases, 1987;40(5):373-83,
-
5Cunningham D, Starling N, Rao S, Iveson T, Nicolson M, Coxon F, et al. Capecitabine and Oxaliplatin for Advanced Esophagogastric Cancer, New England Journal of Medicine, 2008;358(1):36-46,
-
6Cutsem EV, Moiseyenko VM, Tjulandin S, Majlis A, Constenla M, Boni C, et al. Phase III Study of Docetaxel and Cisplatin Plus Fluorouracil Compared With Cisplatin and Fluorouracil As First-Line Therapy for Advanced Gastric Cancer: A Report of the V325 Study Group, Journal of Clinical Oncology, 2006;24(31):4991-7,
-
7Dindo D, Demartines N, Clavien P-A. Classification of Surgical Complications: A New Proposal With Evaluation in a Cohort of 6336 Patients and Results of a Survey, Annals of surgery, 2004;240(2):205-13,
-
8Doyle DJ, Garmon EH; American Society of Anesthesiologists Classification (ASA Class). StatPearls, Treasure Island FL: StatPearls Publishing LLC,; 2017,
-
9Einama T, Abe H, Shichi S, Matsui H, Kanazawa R, Shibuya K, et al. Long-term survival and prognosis associated with conversion surgery in patients with metastatic gastric cancer, Molecular and clinical oncology, 2017 Feb;6(2):163-6,
-
10Enzinger PC, Burtness BA, Niedzwiecki D, Ye X, Douglas K, Ilson DH, et al. CALGB 80403 (Alliance)/E1206: A Randomized Phase II Study of Three Chemotherapy Regimens Plus Cetuximab in Metastatic Esophageal and Gastroesophageal Junction Cancers, Journal of Clinical Oncology, 2016 07/05;34(23):2736-42,
-
11Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012, International journal of cancer, 2015 Mar 01;136(5):E359-86,
-
12Fujitani K, Yang H-K, Mizusawa J, Kim Y-W, Terashima M, Han S-U, et al. Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single non-curable factor (REGATTA): a phase 3, randomised controlled trial, The Lancet Oncology, 2016;17(3):309-18,
-
13Fukuchi M, Ishiguro T, Ogata K, Suzuki O, Kumagai Y, Ishibashi K, et al. Prognostic Role of Conversion Surgery for Unresectable Gastric Cancer, Annals of surgical oncology, 2015 Oct;22(11):3618-24,
-
14Hartgrink HH, Putter H, Klein Kranenbarg E, Bonenkamp JJ, van de Velde CJ. Value of palliative resection in gastric cancer, The British journal of surgery, 2002 Nov;89(11):1438-43,
-
15Ilson DH, Saltz L, Enzinger P, Huang Y, Kornblith A, Gollub M, et al. Phase II Trial of Weekly Irinotecan Plus Cisplatin in Advanced Esophageal Cancer, Journal of Clinical Oncology, 1999;17(10):3270-5,
-
16Isaji S, Mizuno S, Windsor JA, Bassi C, Fernandez-Del Castillo C, Hackert T, et al. International consensus on definition and criteria of borderline resectable pancreatic ductal adenocarcinoma 2017, Pancreatology : official journal of the International Association of Pancreatology (IAP) [et al], 2018 Jan;18(1):2-11,
-
17Ishigami H, Kitayama J, Kaisaki S, Hidemura A, Kato M, Otani K, et al. Phase II study of weekly intravenous and intraperitoneal paclitaxel combined with S-1 for advanced gastric cancer with peritoneal metastasis, Annals of oncology : official journal of the European Society for Medical Oncology, 2010 Jan;21(1):67-70,
-
18Japanese Gastric Cancer A. Japanese gastric cancer treatment guidelines 2014 (ver, 4), Gastric Cancer 2017;20:1-19,
-
19Kinoshita J, Fushida S, Tsukada T, Oyama K, Okamoto K, Makino I, et al. Efficacy of conversion gastrectomy following docetaxel, cisplatin, and S-1 therapy in potentially resectable stage IV gastric cancer, European journal of surgical oncology : the journal of the European Society of Surgical Oncology and the British Association of Surgical Oncology, 2015 Oct;41(10):1354-60,
-
20Morgagni P, Solaini L, Framarini M, Vittimberga G, Gardini A, Tringali D, et al. Conversion surgery for gastric cancer: A cohort study from a western center, International journal of surgery (London, England), 2018 May;53:360-5,
-
21Nakamura T, Hayashi K, Ota M, Eguchi R, Ide H, Takasaki K, et al. Salvage esophagectomy after definitive chemotherapy and radiotherapy for advanced esophageal cancer, American journal of surgery, 2004 Sep;188(3):261-6,
-
22Pereira MA, Ramos MFKP, Dias AR, Yagi OK, Faraj SF, Zilberstein B, et al. Detection of occult lymph node tumor cells in node-negative gastric cancer patients, Arquivos brasileiros de cirurgia digestiva:ABCD, Brazilian archives of digestive surgery, 2017 Jan-Mar;30(1):30-4,
-
23Ramos MFKP, Pereira MA, Barchi LC, Yagi OK, Dias AR, Szor DJ, et al. Duodenal fistula: The most lethal surgical complication in a case series of radical gastrectomy, International journal of surgery (London, England), 2018 Apr 10;53:366-70,
-
24Washington K. 7th edition of the AJCC cancer staging manual: stomach, Annals of surgical oncology, 2010 Dec;17(12):3077-9,
-
25Yamaguchi K, Yoshida K, Tanahashi T, Takahashi T, Matsuhashi N, Tanaka Y, et al. The long-term survival of stage IV gastric cancer patients with conversion therapy, Gastric cancer : official journal of the International Gastric Cancer Association and the Japanese Gastric Cancer Association, 2018 Mar;21(2):315-23,
-
26Yoshida K, Yamaguchi K, Okumura N, Tanahashi T, Kodera Y. Is conversion therapy possible in stage IV gastric cancer: the proposal of new biological categories of classification, Gastric cancer : official journal of the International Gastric Cancer Association and the Japanese Gastric Cancer Association, 2016 Apr;19(2):329-38,
-
27Zilberstein B, Malheiros C, Lourenco LG, Kassab P, Jacob CE, Weston AC, et al. Brazilian consensus in gastric cancer: guidelines for gastric cancer in Brazil, Arquivos brasileiros de cirurgia digestiva : ABCD = Brazilian archives of digestive surgery, 2013 Jan-Mar;26(1):2-6,
-
Fonte de financiamento:
não há
Datas de Publicação
-
Publicação nesta coleção
29 Abr 2019 -
Data do Fascículo
2019
Histórico
-
Recebido
16 Set 2018 -
Aceito
16 Jan 2019