Resumos
O conhecimento dos principais mecanismos de defesa imune contra os diversos agentes infecciosos permite a compreensão da patogênese das doenças infectoparasitárias e das várias estratégias do hospedeiro e do parasita. O sistema imunológico atua numa rede de cooperação, envolvendo a participação de muitos componentes estruturais, moleculares e celulares. Nesse cenário encontra-se o delicado equilíbrio entre a saúde e a doença, em que tanto a deficiência quanto o exagero resultam em dano tecidual. Este artigo explora esses aspectos e algumas abordagens terapêuticas que surgem desse entendimento.
helmintíase; imunidade; imunidade natural; infecção; infecções bacterianas; infecções por protozoários; micoses; viroses
Knowledge acquired about the main immune mechanisms protecting against various infectious agents leads to a better understanding of the pathogenesis of infectious/parasitic diseases and of various strategies specific to the host and parasite. The immune system performs along a cooperation network, which involves the participation of several structural, molecular and cellular components. The fine balance between health and disease is found in this scenario, in which deficiency as much as excess may result in tissue damage. This article explores such aspects and a number of therapies arising from the knowledge acquired.
helminthiasis; immunity; immunity; infection; bacterial infections; protozoan infections; mycoses; virus diseases
EDUCAÇÃO MÉDICA CONTINUADA
Mecanismos de resposta imune às infecções* * Trabalho realizado no Serviço de Imunologia, Hospital Universitário Prof. Edgard Santos, Universidade Federal da Bahia, Salvador, Bahia, Brasil.
Paulo R. L. MachadoI; Maria Ilma A. S. AraújoII; Lucas CarvalhoIII; Edgar M. CarvalhoIV
IDoutor em Medicina. Pesquisador associado do Serviço de Imunologia da UFBA. Professor-assistente de Dermatologia da Fundação Baiana para o Desenvolvimento das Ciências
IIDoutor em Biologia Molecular e Celular. Pesquisador associado do Serviço de Imunologia da UFBA. Professor-assistente de Imunologia da Fundação Baiana para o Desenvolvimento das Ciências
IIIDoutor em Patologia. Pesquisador associado do Serviço de Imunologia da UFBA
IVProfessor titular de Medicina da UFBA. Chefe do Serviço de Imunologia da UFBA
Endereço para correspondência Endereço para correspondência Paulo R. L. Machado Serviço de Imunologia - 5º andar Hospital Universitário Prof. Edgard Santos UFBA Rua João das Botas s/n - Canela Salvador Bahia 40110-160 Fax: (71) 245-7110 E-mail: prlmachado@uol.com.br
RESUMO
O conhecimento dos principais mecanismos de defesa imune contra os diversos agentes infecciosos permite a compreensão da patogênese das doenças infectoparasitárias e das várias estratégias do hospedeiro e do parasita. O sistema imunológico atua numa rede de cooperação, envolvendo a participação de muitos componentes estruturais, moleculares e celulares. Nesse cenário encontra-se o delicado equilíbrio entre a saúde e a doença, em que tanto a deficiência quanto o exagero resultam em dano tecidual. Este artigo explora esses aspectos e algumas abordagens terapêuticas que surgem desse entendimento.
Descritores: helmintíase; imunidade; imunidade natural; infecção/imunologia; infecções bacterianas; infecções por protozoários; micoses; viroses.
INTRODUÇÃO
A resposta imune tem papel fundamental na defesa contra agentes infecciosos e se constitui no principal impedimento para a ocorrência de infecções disseminadas, habitualmente associadas com alto índice de mortalidade. É também conhecido o fato de que, para a quase-totalidade das doenças infecciosas, o número de indivíduos expostos à infecção é bem superior ao dos que apresentam doença, indicando que a maioria das pessoas tem condições de destruir esses microorganismos e impedir a progressão da infecção. Em contraste, as deficiências imunológicas, sejam da imunidade inata (disfunções de células fagocíticas e deficiência de complemento) ou da imunidade adaptativa (deficiência de produção de anticorpos ou deficiência da função de células T), são fortemente associadas com aumento de susceptibilidade a infecções.1
Embora a resposta imune seja fundamental para a defesa contra a maioria de agentes infectantes, têm sido acumuladas nos últimos anos evidências de que em muitas doenças infecciosas os principais aspectos patológicos não estão relacionados com uma ação direta do agente agressor, mas sim com uma resposta imune anormal. Em muitas dessas situações existe uma reação de hipersensibilidade com resposta imune exagerada e não modulada que tem como conseqüência dano tecidual. Em outros casos, agentes infecciosos, seja por mimetizar antígenos próprios, por induzir proliferação de células auto-reativas ou por aumentar nas células infectadas a expressão de moléculas de MHC e moléculas co-estimulatórias, podem desencadear doenças auto-imunes.2
O conhecimento de que diferentes tipos de micróbios são combatidos por diferentes componentes da resposta imune data do início dos anos 50, quando ficou documentada a importância dos anticorpos na destruição de bactérias extracelulares. Embora isoladamente os anticorpos por si só não tenham a capacidade de destruir bactérias, anticorpos podem neutralizar os microorganismos, impedindo sua ligação com o tecido do hospedeiro. Adicionalmente, em associação com o complemento, os anticorpos podem lisar bactérias e funcionar como opsoninas, facilitando a fagocitose. Os neutrófilos, eosinófilos e macrófagos exercem sua ação microbicida de forma mais ampla contra vários tipos de agentes e são células importantíssimas para a defesa do hospedeiro. A documentação de que células fagocíticas expressam em sua membrana receptores como o toll-like receptor (TLR), que se ligam especificamente a padrões moleculares existentes em diversos agentes infectantes,3 torna impróprio denominar inespecífica a resposta imune inata. Os neutrófilos têm ação microbicida fundamental contra bactérias; os macrófagos são células importantes na defesa contra agentes intracelulares (protozoários e bactérias intracelulares); e os eosinófilos, não tanto pela atividade fagocítica, mas pela atividade citotóxica contra helmintos. A resposta mediada pelas células T é extremamente efetiva no mecanismo de defesa contra agentes intracelulares, como vírus, protozoários, fungos e bactérias intracelulares. As células T podem exercer sua função através da citotoxicidade mediada por células CD8+ ou através da secreção de citocinas que vão ativar macrófagos para destruir os agentes intracelulares. Outros elementos que podem participar do processo de defesa contra agentes infecciosos incluem o queratinócito e a célula de Langerhans, já que muitas vezes a pele é invadida por diversos microorganismos. Os queratinócitos possuem a capacidade de secretar inúmeras citocinas, dessa maneira ativando e recrutando células inflamatórias e linfócitos para a pele.4 A célula de Langerhans, por sua vez, exerce o papel fundamental de vigilante do território cutâneo, fagocitando desde partículas protéicas inanimadas até vírus, bactérias ou qualquer outro microorganismo invasor. Após a fagocitose a célula de Langerhans migra para o linfonodo regional a fim de realizar a apresentação antigênica aos linfócitos, dando início ao desenvolvimento de imunidade específica protetora, tolerância ou hipersensibilidade.5
Se de um lado já eram conhecidas as células e os mediadores envolvidos nas defesas dos humanos, só recentemente foi documentado o fato de que a população de células TCD4+ (T helper) é heterogênea, sendo constituída de duas subpopulações: as células Th1 e Th2.6 Essa observação tem contribuído bastante para o entendimento da imunopatogênese da maioria das doenças infecciosas. A figura 1 mostra a dicotomia das células TCD4+ e os mediadores por elas produzidos.
É fundamental o entendimento de que tanto a resposta Th1 como a resposta Th2 são importantes na defesa do hospedeiro contra as infecções. A resposta Th1 está relacionada com a defesa contra protozoários, bactérias intracelulares e vírus, enquanto a resposta Th2 é mais efetiva contra os helmintos e bactérias extracelulares. Essas respostas são também antagônicas, desde que o IFN-g modula negativamente a resposta Th2, e a IL-4 e a IL-10 modulam negativamente a resposta Th1, o que permite uma homeostasia no sistema imune e uma resposta imunológica balanceada. Adicionalmente, as células regulatórias da resposta imune que expressam as moléculas CD4 e CD25 (Tr) e produzem IL-10 e/ou TGF-b (Tr1 ou Th3) estão envolvidas em modular a resposta imune, impedindo ou diminuindo as conseqüências das reações de hipersensibilidade e das doenças auto-imunes.7
1. RESPOSTA IMUNE CONTRA BACTÉRIAS
As bactérias são os microorganismos que mais freqüentemente causam infecções no homem. Tanto as barreiras naturais contra os agentes infectantes, como a imunidade inata e a adaptativa participam do mecanismo de defesa contra as bactérias.
1.1. Bactérias Intracelulares
A característica principal é a capacidade de sobreviver dentro dos macrófagos, tendo como exemplos o M. tuberculosis, o M. leprae e a L. monocitogenesis. A penetração no macrófago constitui também um mecanismo de escape do parasita e, embora paradoxal, é também útil para o hospedeiro, desde que a ausência de penetração celular da bactéria poderia induzir uma forte resposta inflamatória e um excessivo dano para o hospedeiro. Dentro dos macrófagos essas bactérias podem estimular tanto as células TCD4+ através da expressão de antígeno associado ao MHC classe II, como também células TCD8+ através da expressão de antígenos associados a moléculas do MHC classe I. A ativação de células TCD4+ leva à secreção de IFN-g, que ativa os macrófagos levando à produção aumentada de óxido nítrico (NO) e destruição da bactéria. As células TCD8+ participam do mecanismo de defesa através da citotoxicidade, destruindo os macrófagos infectados. No caso do M. tuberculosis, a despeito de haver imunidade protetora impedindo sua multiplicação, não existe a eliminação completa do bacilo. Por essa razão indivíduos em uso de corticosteróides e portadores de HIV podem desenvolver manifestações clínicas de tuberculose, a despeito de terem sido infectados há muito tempo e terem persistido completamente assintomáticos. O papel da resposta imune celular no controle das infecções causadas por micobactérias é bem demonstrado pela expansão dessas infecções com o advento da Aids.
Com referência à infecção causada por M. leprae, o espectro clínico da doença está intimamente ligado à resposta imune. Nos pacientes com a forma tuberculóide existe uma forte resposta Th1, e a doença se caracteriza por destruição das fibras nervosas em áreas específicas, levando ao aparecimento na pele de lesões localizadas e bem demarcadas, com perda de sensibilidade térmica e dolorosa. Na ausência de uma resposta Th1, ocorre disseminação do bacilo, levando ao quadro da hanseníase virchowiana. Nesse caso os macrófagos estão repletos de parasita e há escassez de linfócitos na lesão. As formas borderlines, também conhecidas como dimorfas, representam um padrão clínico e imunológico de resposta intermediária.8
A importância da resposta imune na hanseníase não se restringe à determinação do espectro clínico; no decorrer da doença ou muitas vezes após início do tratamento alguns pacientes podem apresentar manifestações clínicas agudas secundárias à liberação de antígenos e a reações de hipersensibilidade. Essas manifestações, também denominadas reações, são representadas pelo eritema nodoso hansênico (ENH) e pela reação reversa (RR). O ENH é uma resposta inflamatória sistêmica associada a altas concentrações de TNF-a e à deposição de imunocomplexos, com infiltração de neutrófilos e ativação de complemento, comprometendo vários órgãos.9,10 A imunopatogênese do ENH é bastante complexa: têm sido demonstrados no soro dos pacientes altos níveis circulantes de IL-1 e TNF-a,11,12 enquanto um aumento tecidual na expressão de RNA mensageiro para IL-6, IL-8 e IL-10 indica resposta Th2;10,13 além disso, é documentada a presença da enzima óxido nítrico sintase induzível (iNOS) nos neutrófilos e de TNF-a e TGF-b nos macrófagos das lesões.14 O ENH pode acompanhar-se de toxicidade sistêmica, sendo muitas vezes tratado com corticosteróides ou drogas inibidoras do TNF-a, como a talidomida. Por outro lado, a RR desenvolve-se após o aparecimento abrupto de um mecanismo de hipersensibilidade tardia contra frações antigênicas do M. leprae, envolvendo participação ativa de linfócitos T com produção tecidual de citocinas Th1 (IL-2, IFN-g) e citocinas inflamatórias, como TNF-a.13 As lesões apresentam-se infiltradas por linfócitos CD4+, com aumento da expressão de HLA-DR e do receptor para IL-2 em células do infiltrado, assim como nos queratinócitos.15
1.2. Bactérias Extracelulares
As infecções causadas por bactérias extracelulares são as mais freqüentes. Nesses casos os mecanismos de defesa estão relacionados principalmente com as barreiras naturais do hospedeiro, a resposta imune inata e a produção de anticorpos.
A importância das barreiras naturais no combate às infecções bacterianas extracelulares é bem reconhecida. A integridade da pele e das mucosas impede a aderência e a penetração de bactérias; o movimento mucociliar elimina bactérias do trato respiratório; o pH ácido do estômago destrói bactérias que penetram pelo trato digestivo alto; e na saliva e secreções prostáticas existem substâncias com atividade antimicrobiana. A quadro 1 detalha os principais mecanismos de defesa contra bactérias extracelulares.
A participação da imunidade inata ocorre através das células fagocitárias, da ativação do sistema complemento pela via alternativa e da produção de quimiocinas e citocinas. Adicionalmente a proteína C reativa (PCR), proteína de fase aguda produzida principalmente por células hepáticas nas infecções bacterianas, exerce ação variada contra as bactérias. Ao ligar-se aos fosfolipídios de membrana de algumas bactérias (por exempço, pneumococos) a PCR atua como opsonina, facilitando a fagocitose por neutrófilos. A PCR tem também a capacidade de ativar o sistema complemento e também estimula a síntese de TNF-a, a qual induz a síntese de NO e conseqüentemente a destruição de vários microorganismos.
O complemento exerce seu papel de defesa pela ativação do complexo de ataque à membrana (C5-C9) e facilitando a opsonização através do componente C3b, que se liga à bactéria e interage em uma segunda etapa com um receptor específico existente nas células fagocíticas. As deficiências do sistema complemento têm sido associadas com infecções graves por Neisseria meningitidis e infecções disseminadas por Neisseria gonorheae.16
Todas as células da imunidade inata participam da defesa contra bactérias, embora seja enfatizado principalmente o papel de neutrófilos e monócitos/macrófagos pela capacidade fagocítica dessas células. Os basófilos e mastócitos ativados por fatores do sistema complemento, a exemplo do C5a, C3a e C4a, liberam mediadores que, juntamente com as referidas proteínas do complemento, atraem leucócitos para o sítio de agressão e contribuem para a passagem dessas células dos vasos para os tecidos, local onde está ocorrendo a agressão ao hospedeiro. Os eosinófilos, além da atividade fagocítica, podem destruir microorganismos por meio da liberação de proteínas com atividade microbicida, tais como a proteína básica principal e a proteína catiônica eosinofílica. Os neutrófilos e os macrófagos têm participação importante na defesa contra esses agentes desde que as bactérias sejam susceptíveis a substâncias produzidas por essas células, a exemplo do NO e do peróxido de hidrogênio. Existem também no interior dessas células, enzimas como a mieloperoxidase e substâncias outras como a azurocidina, que possuem propriedade microbicida. Embora tanto os neutrófilos como os macrófagos sejam células fagocíticas, essas células possuem características bem diferentes. Enquanto os neutrófilos têm vida curta tanto no sangue como nos tecidos, os macrófagos têm sobrevida prolongada. Os neutrófilos só são encontrados nos tecidos inflamados, enquanto os macrófagos concentram-se tanto em tecidos inflamados como em tecido sadio. Durante a reação inflamatória os neutrófilos produzem secreção purulenta, enquanto os macrófagos formam o granuloma. Os neutrófilos defendem principalmente contra as bactérias extracelulares, enquanto os macrófagos são fundamentais para a eliminação dos agentes intracelulares que albergam.
As células da resposta imune são também as principais fontes de citocinas e quimiocinas no início das infecções, as quais exercem sua ação tanto na fase inata como na adaptativa. As quimiocinas, devido a seu papel de atrair células para o sítio da lesão, são muito importantes no processo de defesa do hospedeiro.17
Entre as várias citocinas que participam da defesa contra bactérias, tem sido dado destaque às citocinas pró-inflamatórias, como o TNF-a, IL-1 e IL-6. Essas citocinas são produzidas nas fases iniciais da infecção e são responsáveis, por meio de sua ação no hipotálamo, pelo aparecimento da febre que inibe a multiplicação bacteriana. Elas aumentam a expressão das moléculas de adesão (seletina P e ICAM), facilitando a passagem de células de vaso para o sítio da infecção, e também estimulam os neutrófilos e macrófagos a produzirem NO e a destruírem bactérias. Outras citocinas produzidas nas fases iniciais da infecção interferem na resposta imune adaptativa. A IL-12, produzida por macrófagos, tem papel importante na diferenciação de células Th0 para Th1,18 enquanto a IL-4, produzida por basófilos, mastócitos e macrófagos, estimula a diferenciação de células Th0 para Th2, que vão colaborar com o linfócito B na produção de anticorpos, mais especificamente, da IgE.19
A imunidade adaptativa, principalmente mediante os anticorpos, desempenha importante papel na defesa contra as bactérias extracelulares. Os anticorpos podem exercer suas ações de três maneiras: 1) opsonização, 2) ativando o sistema complemento, 3) promovendo a neutralização de bactérias ou de seus produtos.
Como as bactérias extracelulares são susceptíveis à destruião quando fagocitadas, elas desenvolvem, como mecanismo de escape, substâncias que possuem atividade antifagocítica. Anticorpos dirigidos contra essas substâncias não só impedem sua ação, mas facilitam a fagocitose, desde que neutrófilos e macrófagos possuam receptor para a porção FC da imunoglobulina (opsonização). Os anticorpos também são coadjuvantes na destruição de bactérias por complemento, ativando esse sistema pela via clássica. Por meio do mecanismo de neutralização, os anticorpos, principalmente a IgA, podem ligar-se a bactérias e, com isso, impedir que as mesmas se fixem nas mucosas, como no trato intestinal e no trato respiratório. Os anticorpos em muitas ocasiões ligam-se a toxinas produzidas por bactérias, como as toxinas tetânica e diftérica, neutralizando a ação desses produtos.
A despeito da importância defensiva da resposta imune, a dificuldade em controlar a resposta inflamatória que se desenvolve pode provocar dano nos próprios tecidos, muitas vezes limitado e sem maiores conseqüências para o hospedeiro. Porém, eventualmente, infecções causadas por germes gram-negativos podem resultar em septicemia e choque séptico, situação extremamente grave e associada com alta taxa de mortalidade. O choque séptico é desencadeado por lipopolissacarídeos (LPS) presentes na parede bacteriana estimulando nos neutrófilos, macrófagos, células endoteliais e músculos uma produção exacerbada de citocinas pró-inflamatórias (TNF-a, IL-1, IL-6, IL-8) e NO. Como conseqüência, há diminuição do tônus muscular e do débito cardíaco, que resulta em hipotensão e má perfusão tecidual, e finalmente morte celular. No entanto, a modulação dessa resposta exacerbada pode ser obtida. Assim, em modelo experimental a administração concomitante de IL-10 e LPS protege camundongos da morte por choque séptico, ao inibir a produção de IL-12 e síntese de IFN-g e TNF-a.20
2. RESPOSTA IMUNE NAS INFECÇÕES VIRAIS
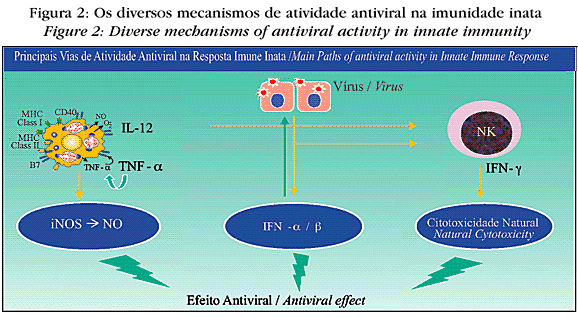
A despeito dos múltiplos mecanismos de defesa contra os vírus, as doenças virais não só são comuns, como hoje representam uma das mais importantes doenças infecciosas associadas com a mortalidade da população. A figura 2 mostra como os vírus são destruídos por meio da reposta imune inata. Na fase inicial das infecções virais, o controle dessas infecções é feito pelos interferons tipo I (IFN-a e IFN-b), pelos macrófagos e pelas células NK.21
Os interferons tipo I são produzidos por células infectadas por vírus e, ao interagir com uma célula não infectada, têm a propriedade de protegê-la contra a infecção, além de colaborar com a resposta imune adaptativa. O IFN-g também atua contra as infecções virais mediante a ativação dos macrófagos com destruição dos vírus e também das células NK (células citotóxicas naturais), as quais, pela liberação de granzima e perfurina, destroem as células infectadas. Adicionalmente, a IL-12 possui participação importante na fase inicial, sendo produzida por macrófagos e outras células apresentadoras de antígenos, estimulando as células NK a exercer citotoxicidade e a produzir mais IFN-g, que por sua vez aumenta o potencial microbicida dos macrófagos.
A imunidade adaptativa contra os antígenos virais ocorre com ativação de células TCD8+ que vão exercer citotoxicidade pelo reconhecimento de antígenos virais via MHC classe I nas células alvo, e conseqüente liberação de granzima e de perfurinas com lise das células infectadas e também dos vírus. Durante a resposta imune adaptativa há também ativação das células TCD4+, que vão colaborar com as células B na produção de anticorpos. A despeito de os vírus serem agentes intracelulares, os anticorpos têm papel importante no combate às infecções virais, desde que, por ocasião da propagação da infecção viral, após multiplicarem-se em células infectadas, os vírus rompem essas células, ficando livres até a penetração em outra célula. Nessa fase extracelular os anticorpos podem ligar-se aos vírus e, por meio do mecanismo de neutralização, impedir que eles penetrem uma célula não infectada. Alternativamente, anticorpos podem ser adjuvantes no mecanismo de citotoxicidade celular dependente de anticorpos, ao se ligar às células infectadas, permitindo a ação das células NK. Em várias doenças, a exemplo de poliomielite, sarampo, hepatite B e varicela, o anticorpo tem papel fundamental na proteção contra a infecção quando se trata de um hospedeiro previamente sensibilizado, seja por uma infecção prévia ou por imunização. Isso porque, em indivíduos já sensibilizados, a presença de anticorpos pode interceptar os vírus, impedindo sua ligação com a célula do hospedeiro.
Em virtude dos múltiplos mecanismos de defesa contra os vírus, grande parte das infecções virais é assintomática ou tem uma apresentação subclínica com manifestações inespecíficas, como febre e rash cutâneo. Todavia, várias infecções virais progridem, e dano tecidual importante pode ocorrer. A patologia associada à infecção viral pode estar relacionada com um efeito citopático do vírus, reação de hipersensibilidade e fenômenos auto-imunes (Figura 3).
Em muitas infecções virais a destruição de célula acontece por mais de um desses mecanismos. Por exemplo, na infecção pelo HIV e nas infecções pelo vírus B e vírus C da hepatite, a destruição da células infectada é mediada tanto pelo efeito citopático do vírus como através de citotoxicidade por células NK e células CD8. Algumas infecções virais exemplificam bem a ampla dimensão dos mecanismos de agressão tecidual que ocorrem no curso dessas infecções.
2.1. Vírus da Imunodeficiência Humana (HIV)
O HIV infecta predominantemente as células TCD4+, e a destruição dessas células pode ocorrer pelo efeito citopático do vírus. Adicionalmente, existe um aumento da apoptose dessas células e, por expressarem antígenos virais no nível da membrana, as células podem também ser destruídas por citotoxicidade mediada pela célula TCD8+, fenômeno que também contribui para a redução das células CD4+. Sendo a célula TCD4+ uma das mais importantes na cooperação da resposta imune, a diminuição numérica e a alteração de sua função levam a uma supressão da resposta imunológica. Essa supressão está associada predominantemente com a diminuição de IL-2, IFN-g e TNF-a.22 Por essa razão, em pacientes com Aids, as principais infecções oportunistas estão relacionadas a agentes intracelulares, tais como: M. tuberculosis, P. carinii, citomegalovírus, C. albicans e criptosporidium. Como na infecção pelo HIV os linfócitos B de memória estão funcionando, anticorpos são produzidos, e o mecanismo de defesa contra agentes extracelulares não é prejudicado em grande escala. Essa ausência de maior susceptibilidade para infecções bacterianas extracelulares observada em pacientes com Aids é, entretanto, observada em adultos nos quais o repertório de anticorpos produzido por células B e dependente de células T já estava formado antes da infecção pelo HIV. Em crianças infectadas, como a alteração do funcionamento das células TCD4+ é precoce, a cooperação celular é prejudicada, havendo também anormalidade na síntese de anticorpos. Por esta razão, infecções por bactérias extracelulares são comuns em crianças com HIV.
2.2. Vírus Linfocitotrópico de células T humanas (HTLV-1)
A infecção pelo HTLV-1 induz ativação e intensa proliferação celular dos linfócitos T infectados. Esse fenômeno relaciona-se principalmente com a função do gene Tax do vírus que tem a propriedade de transativar os genes da IL-2, e do receptor da IL-2. Essa proliferação anômala de células T pode levar ao aparecimento da leucemia de células T do adulto. A proliferação indiscriminada de células pode provocar também a expansão de células T auto-reativas e secreção acentuada de citocinas pró-inflamatórias como o TNFa. Essas anormalidades podem associar-se com lesão tecidual cutânea e neurológica.23
Em virtude da forte ativação de células Th1 na infecção pelo HTLV-1, ocorre uma redução da produção de IL-4 e IL-5 e diminuição da síntese da IgE e da ativação de mastócitos e eosinófilos, componentes da resposta protetora contra helmintos. Assim, existe uma maior prevalência de esquistossomose e estrongiloidíase em pacientes infectados pelo HTLV-1,24 podendo ocorrer disseminação da larva do S. stercoralis com aparecimento de formas graves de estrongiloidíase.25
2.3. Papiloma vírus humano (HPV)
O HPV é um vírus DNA que, além de causar a verruga vulgar e o condiloma acuminado, está fortemente associado ao desenvolvimento de neoplasia cervical e desenvolvimento de câncer de pele, principalmente em indivíduos imunossuprimidos. O envolvimento do HPV com câncer de pele foi também demonstrado em pacientes com epidermodisplasia verruciforme em que DNA viral foi detectado em lesões maculares.26
A resposta imune contra o HPV de uma forma geral é mediada pela resposta imune celular a despeito de anticorpos da classe IgG e IgA contra frações antigênicas serem encontrados no muco cervical de pacientes com neoplasia cervical.27,28 Infiltrado inflamatório composto de macrófagos e células CD4+ é observado em condilomas que regridem espontaneamente, e a resposta linfoproliferativa de células T CD4+ específica para o antígeno E2 demonstrou-se associada à eliminação do HPV. Por outro lado, células CD8+ específicas para os antígenos E6 e E7 são encontradas em pacientes com grandes lesões ou com tumor cervical. Além disso, diminuição da resposta tipo 1 com baixa produção de IL-2, IFN-g e TNF-a é observada em pacientes com lesão intraepitelial de alto grau.29
3. RESPOSTA IMUNE NAS INFECÇÕES CAUSADAS POR PROTOZOÁRIOS
As principais doenças causadas por protozoários no homem são as leishmanioses, doença de Chagas, malária, toxoplasmose e amebíase. Os protozoários são agentes infecciosos intracelulares que habitualmente infectam o hospedeiro por longo período de tempo, em virtude de possuir mecanismos que lhes permitem escapar das agressões mediadas pelo sistema imune. De maneira adicional, as infecções por protozoários habitualmente só causam doença em uma parcela dos indivíduos infectados, indicando que o sistema imune não permite, na maioria das vezes, a multiplicação em grande escala dos protozoários e a disseminação da infecção, sem, porém, ter a capacidade de promover esterilização. Dessa forma, esses agentes podem permanecer no hospedeiro por toda a vida, até sem causar doença, a não ser que esse equilíbrio seja perdido por uma depressão imune ou pelo desencadeamento de uma resposta imunitária exacerbada com inflamação tecidual.
Vários componentes da resposta imune inata participam do mecanismo de defesa contra os protozoários, mas esses microorganismos escapam dessa defesa.30 Embora in vitro as promastigotas de Leishmania sejam altamente sensíveis ao complemento, as formas infectantes resistem a sua ação. O Tripanosoma cruzi, por sua vez, tem a propriedade de impedir ativação do complemento, desde que se encubra com moléculas do hospedeiro como o fator acelerador da degradação (DAF). As leishmanias são também susceptíveis à ação de neutrófilos, células com grande potencial de produzir peróxido de hidrogênio e NO, mas que, ao penetrar o hospedeiro, infectam os macrófagos, livrando-se do ataque dos neutrófilos. A resposta adaptativa contra os protozoários ocorre após a apresentação de antígenos por macrófagos e células dendríticas, via MHC classe II para as células T. Como outras células podem ser infectadas, e os macrófagos e células dendríticas também expressam moléculas de MHC classe I, nas infecções por protozoários há também ativação das células TCD8+. O quadro 2 mostra os mecanismos imunológicos de defesa contra alguns protozoários de importância clínica.
À exceção da Giardia lamblia, que pode causar infecção grave em pacientes com deficiência de produção de anticorpos, a resposta imune celular é fundamental na defesa contra infecções causadas por protozoários.
Embora nas infecções causadas por agentes intracelulares uma resposta imune desviada para o pólo Th2 seja maléfica, porque aumenta a susceptibilidade às infecções e permite a multiplicação e disseminação do parasito o conceito de que uma potente resposta Th1 seja protetora deve ser visto com reserva. Em várias doenças causadas por protozoários, existem evidências de que a resposta imune exacerbada está envolvida no dano tecidual: na amebíase é dependente da ação de neutrófilos;31 na doença de Chagas é mediado por células CD4+ e CD8+;32 uma maciça produção de TNF-a e NO, documentada na patogenia da malária cerebral.33 Esses fatos indicam que uma atuação equilibrada do sistema imunológico é muito importante para a contenção do parasita sem destruição tecidual, fazendo com que, embora possa continuar presente, o agente infectante não cause doença no homem.
A patogênese das diversas formas clínicas da leishmaniose exemplifica bem a importância da resposta Th1 tanto no controle como na gênese da lesão tecidual. As formas clínicas mais comuns da leishmaniose são a leishmaniose tegumentar (leishmaniose cutânea, leishmaniose mucosa e leishmaniose cutânea difusa) e a leishmaniose visceral. O quadro 3 mostra a associação entre as diversas formas clínicas de leishmaniose, a espécie da Leishmania e a resposta imune.
Após a inoculação da Leishmania na pele e invasão macrofágica, nos indivíduos que não têm a capacidade de produzir IFN-g e ativar macrófagos, a Leishmania dissemina-se e, na dependência da espécie, causa a leishmaniose visceral (L. chagasi) ou a leishmaniose cutânea difusa (L. amazonensis). Nesses pacientes é fácil entender o desenvolvimento da doença, pela deficiência de IFN-g e alta produção de IL-10. A restauração da resposta imune in vitro na leishmaniose visceral pode ser observada pela neutralização de IL-10 ou pela adição de IL-12 às culturas de células mononucleares de sangue periférico (CMSP).34
Atípico, entretanto, é o que ocorre na leishmaniose cutânea e na leishmaniose mucosa, situações nas quais existe um forte desvio Th1 e, embora o número de parasitas no tecido seja escasso ou até ausente, há desenvolvimento de lesão. CMSP de indivíduos com leishmaniose cutânea e leishmaniose mucosa estimuladas com antígeno de Leishmania produzem grande quantidade de IFN-g, IL-2 e TNF-a, e pouca IL-10. Como habitualmente o sistema imune não consegue destruir completamente as leishmanias, essa forte resposta Th1 termina por levar a ocorrência de uma reação inflamatória muito intensa e a dano aos tecidos próprios, resultando no aparecimento de úlceras na pele e na mucosa. Tem participação importante nesse dano tecidual a produção acentuada de TNF-a e de NO. Evidências de que a resposta imune celular participa da patogenia da leishmaniose cutânea e leishmaniose mucosa incluem: 1) o tratamento precoce da infecção não impede o aparecimento da lesão;35 2) existência de forte reação inflamatória no tecido com expressão aumentada de TNF-a, IFN-g e poucos parasitos na lesão;34,36 3) associação de antimonial com droga inibidora de TNF-a cura pacientes com leishmaniose mucosa que são refratários ao tratamento com antimonial.37
4. RESPOSTA IMUNE A FUNGOS
O principal mecanismo de defesa contra fungos é desenvolvido pelos fagócitos, que os destroem por meio da produção de NO e de outros componentes secretados por essas células. Adicionalmente, há participação de IFN-g, aumentando a função de neutrófilos e macrófagos, não havendo evidências de atividade citotóxica por células T CD8+. Portanto, pacientes que apresentam neutropenia (menos de 500 neutrófilos/mm3) ou que tenham deficiência da imunidade celular cursam com freqüência com micoses recorrentes e ocasionalmente desenvolvem formas graves e profundas.38
Embora um grande número de espécie de fungos possa causar doenças no homem, a maioria deles causa doença limitada, sem maiores repercussões clínicas. Destacam-se entre os fungos que estão associados com morbidade no Brasil a Candida albicans, o Criptococcus neoformans e o Paracoccidiodis braziliensis. Apesar de a infecção por C. albicans causar habitualmente infecções leves e sem maiores conseqüências, pacientes infectados com HIV não apresentam apenas alta prevalência da infecção por C. albicans, mas também envolvimento de esôfago, estômago e intestino, sendo comuns infecções recorrentes. Em crianças que apresentam alteração na resposta imune celular e distúrbios endócrinos múltiplos, o quadro raro de candidíase mucocutânea crônica é descrito. Nessas crianças observam-se uma diminuição da resposta Th1 e lesões cutâneas, mucosas e ungueais graves.39
A despeito de a candidíase vaginal ser extremamente freqüente e sem maiores conseqüências, cerca de 5% das mulheres em idade reprodutiva apresentam um quadro de candidíase vaginal recorrente devido à ausência ou a baixos níveis de IFN-g, que pode ser restaurada in vitro pela neutralização da IL-10.40 Embora não seja documentada uma resposta Th2 contra antígenos de C. albicans, a elevada freqüência de atopia nessas pacientes sugere que uma reação de hipersensibilidade imediata a diversos antígenos pode participar da patogênese da doença, com alguns casos se beneficiando de imunoterapia.41
O Criptococcus neoformans pode causar doenças pulmonares e comprometer o sistema nervoso central em pacientes imunossuprimidos, e o P. braziliensis é o agente causal da blastomicose sul-americana. A blastomicose sul-americana caracteriza-se por envolvimento de gânglios, mucosa bucal e do aparelho respiratório. Na maioria das pessoas infectadas o agente é controlado, e o indivíduo fica completamente assintomático. Quando não se desenvolve uma resposta Th1 há disseminação do fungo com envolvimento de órgãos do sistema reticuloendotelial e do pulmão; nesse contexto o papel da IL-4 parece importante, já que em modelo experimental a ausência dessa citocina protege contra doença pulmonar grave.42
5. RESPOSTA IMUNOLÓGICA NAS INFECÇÕES POR HELMINTOS
Os mecanismos de resposta imune nas infecções helmínticas são múltiplos devido ao tamanho e à diversidade metabólica dos parasitas, que são antigenicamente complexos. Um problema adicional é que os parasitas podem sobreviver por muitos anos no hospedeiro, como resultado de mecanismos de escape, a exemplo do que acontece com o S. mansoni, que se torna coberto por antígenos do hospedeiro, deixando de ser estranho para o sistema imunológico.43
Embora o complemento e outros fatores da resposta imune natural possam contribuir para a defesa contra a infecção por helmintos, a resposta imune específica com a produção de anticorpos e citocinas é importante. As células T CD4+ ou TCD8+ do tipo 2 são produtoras de citocinas como IL-4, IL-5 e IL-13 que, entre outras funções, induzem a produção de IgE pelas células B e ativação de eosinófilos, mastócitos e basófilos, respectivamente, componentes fundamentais na defesa contra helmintos.44 Anticorpos da classe IgE ligam-se aos basófilos circulantes ou mastócitos teciduais, induzindo a liberação de histamina e outros mediadores da reação de hipersensibilidade imediata, que leva à destruição de helmintos. A IgE produzida em altos níveis na resposta imunológica do tipo Th2 tem sido relacionada com defesa contra reinfecção pelo S. mansoni.45 Eosinófilos têm também a capacidade de destruir os esquistossômulos e o Strongyloides através do mecanismo de citotoxicidade celular dependente do anticorpo.46 As células do tipo Th2 estão associadas com a resistência à infecção não apenas do S. mansoni, mas dos helmintos intestinais, a exemplo do S. stercoralis e A. lumbricoides. A IL-4 estimula a produção de IgE e, juntamente com a IL-13, a de mastócitos, resultando em aumento da secreção de mediadores da inflamação, secreção de muco e aumento da contratilidade da musculatura intestinal, facilitando a expulsão dos vermes adultos.47
Na fase aguda da esquistossomose as manifestações clínicas de febre, astenia, perda de peso, dor abdominal, diarréia e tosse, além de complicações como pleurite e pericardite, são decorrentes da presença de TNF-a, IL-1 e IL-6, e também da deposição de complexos imunes.48 A melhora da sintomatologia coincide com a produção de IL-10 induzida pelos antígenos de ovos na fase crônica.49 Nessa fase também ocorre secreção de IL-4, IL-5 e IL-13,50,51 que em modelos experimentais participam da formação do granuloma e da fibrose hepática, e, portanto, da patogênese da esquistossomose. 
Recebido em 15.11.2004
Aprovado pelo Conselho Editorial e aceito para publicação em 28.11.2004
- 1. Janeway CA Jr. How the immune system protects the host from infection. Microbes Infect. 2001;3:1167-71.
- 2. Cooke A, Zaccone P, Raine T, Phillips JM, Dunne DW. Infection and autoimmunity: are we winning the war, only to lose the peace? Trends Parasitol. 2004;20:316-21.
- 3. Pasare C, Medzhitov R. Toll-like receptors and acquired immunity. Semin Immunol. 2004;16:23-6.
- 4. Debenedictis C, Joubeh S, Zhang G, Barria M, Ghohestani RF. Immune functions of the skin. Clin Dermatol. 2001; 19:573-85.
- 5. Romani N, Holzmann S, Tripp CH, Koch F, Stoitzner P. Langerhans cells - dendritic cells of the epidermis. APMIS. 2003;111:725-40.
- 6. Mosmann TR, Coffman RL. TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annu Rev Immunol. 1989;7:145-73.
- 7. Mills KH, McGuirk P. Antigen-specific regulatory T cells-their induction and role in infection. Semin Immunol. 2004;16:107-17.
- 8. Britton WJ, Lockwood DNJ. Leprosy. The Lancet. 2004;363:1209-19.
- 9. Goulart IMB, Penna GO, Cunha G. Imunopatologia da hanseníase: a complexidade dos mecanismos da resposta imune do hospedeiro ao Mycobacterium leprae. Rev Bras Med Trop. 2002, 35:365-75.
- 10. Naafs B. Leprosy reactions. New knowledge. Trop Geogr Med. 1994;46:80-4.
- 11. Moreira AL, Sampaio EP, Zmuidzinas A, Frindt P, Smith KA, Kaplan G. Thalidomide exerts its inhibitory action on tumor necrosis factor alpha by enhancing mRNA degradation. J Exp Med. 1993;177:1675-80.
- 12. Sarno EN, Grau GE, Vieira LM, Nery JA. Serum levels of tumour necrosis factor-alpha and interleukin-1 beta during leprosy reactional states. Clin Exp Immunol. 1991;84:103-8.
- 13. Yamamura M, Wang XH, Ohmen JD, Uyemura K, Rea TH, Bloom BR, et al Cytokine patterns of immunologically mediated tissue damage. J Immunol. 1992;149:1470-5.
- 14. Foss NT. Aspectos imunológicos da hanseníase. Medicina (Ribeirão Preto) 1999; 30: 335-9.
- 15. Modlin RL, Melancon-Kaplan J, Young SMM, Pirmez C, Kino H, Convit J, et al Learning from lesions: patterns of tissue inflammation in leprosy. Proc Natl Acad Sci USA. 1988; 85: 1213-7.
- 16. Barrington R, Zhang M, Fischer M, Carroll MC. The role of complement in inflammation and adaptive immunity. Immunol Rev. 2001;180:5-15.
- 17. Dong VM, McDermott DH, Abdi R. Chemokines and diseases. Eur J Dermatol. 2003;13:224-30.
- 18. Manetti R, Parronchi P, Giudizi MG, Piccinni MP, Maggi E, Trinchieri G, et al Natural killer cell stimulatory factor (interleukin 12 [IL-12]) induces T helper type 1 (Th1)-specific immune responses and inhibits the development of IL-4-producing Th cells. J Exp Med. 1993;177:1199-204.
- 19. Bacharier LB, Geha RS. Molecular mechanisms of IgE regulation. J Allergy Clin Immunol. 2000;105:S547-58.
- 20. Caille V, Bossi P, Grimaldi D, Vieillard-Baro A. Physiopathology of severe sepsis. Presse Med. 2004;33:256-61.
- 21. Chadha KC, Ambrus JL Jr, Dembinski W, Ambrus JL Sr. Interferons and interferon inhibitory activity in disease and therapy. Exp Biol Med. 2004; 229:285-90.
- 22. Kedzierska K, Crowe SM. Cytokines and HIV-1: interactions and clinical implications. Antivir Chem Chemother. 2001;12:133-50.
- 23. Barmak K, Harhaj EW, Wigdahl B. Mediators of central nervous system damage during the progression of human T-cell leukemia type I-associated myelopathy/tropical spastic paraparesis. J Neurovirol. 2003;9:522-9.
- 24. Porto AF, Neva FA, Bittencourt H, Lisboa W, Thompson R, Alcântara L, Carvalho EM. HTLV-1 decreases Th2 type of immune response in patients with strongyloidiases. Parasite Imunol. 2001; 23:503-07.
- 25. Porto MA, Muniz A, Oliveira Junior J, Carvalho EM. Clinical and immunological consequences of the association between HTLV-1 and strongyloidiasis. Rev Soc Bras Med Trop. 2002;35:641-9.
- 26. Pfister H, Ter Schegget J. Role of HPV in cutaneous premalignant and malignant tumors. Clin Dermatol. 1997;15:335-47.
- 27. Dillner L, Bekassy Z, Jonsson N, Moreno-Lopez J, Blomberg J. Detection of IgA antibodies against human papillomavirus in cervical secretions from patients with cervical intraepithelial neoplasia. Int J Cancer. 1989;43:36-40.
- 28. Dillner L, Fredriksson A, Persson E, Forslund O, Hansson BG, Dillner J. Antibodies against papillomavirus antigens in cervical secretions from condyloma patients. J Clin Microbiol. 1993;31:192-7.
- 29. Lee BN, Follen M, Shen DY, Malpica A, Adler-Storthz K, Shearer WT, et al. Depressed type 1 cytokine synthesis by superantigen-activated CD4+ T cells of women with human papillomavirus-related high-grade squamous intraepithelial lesions. Clin Diagn Lab Immunol. 2004;11:239-44.
- 30. Zambrano-Villa S, Rosales-Borjas D, Carrero JC, Ortiz-Ortiz L. How protozoan parasites evade the immune response. Trends Parasitol. 2002;18:272-8.
- 31. Ventura-Juarez J, Jarillo-Luna RA, Fuentes-Aguilar E, Pineda-Vazquez A, Munoz-Fernandez L, Madrid-Reyes JI, et al Human amoebic hepatic abscess: in situ interactions between trophozoites, macrophages, neutrophils and T cells. Parasite Immunol 2003;25:503-11.
- 32. Gomes JA, Bahia-Oliveira LM, Rocha MO, Martins-Filho OA, Gazzinelli G, Correa-Oliveira R. Evidence that development of severe cardiomyopathy in human Chagas' disease is due to a Th1-specific immune response. Infect Immun. 2003;71:1185-93.
- 33. Artavanis-Tsakonas K, Tongren JE, Riley EM. The war between the malaria parasite and the immune system: immunity, immunoregulation and immunopathology. Clin Exp Immunol. 2003;133:145-52.
- 34. Ribeiro de Jesus A, Almeida RP, Lessa H, Bacellar O, Carvalho EM. Cytokine profile and pathology in human leishmaniasis. Braz. J. Med. Biol. Res. 1998;31:143-8.
- 35. Machado P, Araujo C, Da Silva AT, Almeida RP, D'Oliveira Jr A, Bittencourt A, et al Failure of early treatment of cutaneous leishmaniasis in preventing the development of an ulcer. Clin Infect Dis. 2002;34:E69-73.
- 36. Pirmez C, Yamamura M, Uyemura K, Paes-Oliveira M, Conceição-Silva F, Modlin RL. Cytokine patterns in the pathogenesis of human leishmaniasis. J Clin Invest. 1993; 91: 1390-5.
- 37. Lessa HA, Machado P, Lima F, Cruz AA, Bacellar O, Guerreiro J, et al Successful treatment of refractory mucosal leishmaniasis with pentoxifylline plus antimony. Am J Trop Med Hyg. 2001; 65:87-9.
- 38. Romani L. Immunity to fungal infections. Nat Rev Immunol. 2004;4:1-23.
- 39. Lilic D. New perspectives on the immunology of chronic mucocutaneous candidiasis. Curr Opin Infect Dis. 2002;15:143-7.
- 40. Carvalho LP, Bacellar O, Neves N, de Jesus AR, Carvalho EM. Downregulation of IFN-gamma production in patients with recurrent vaginal candidiasis. J Allergy Clin Immunol. 2002;109:102-5.
- 41. Moraes PS, de Lima Goiaba S, Taketomi EA. Candida albicans allergen immunotherapy in recurrent vaginal candidiasis. J Investig Allergol Clin Immunol. 2000;10:305-9.
- 42. Pina A, Valente-Ferreira RC, Molinari-Madlum EE, Vaz CA, Keller AC, Calich VL. Absence of interleukin-4 determines less severe pulmonary paracoccidioidomycosis associated with impaired Th2 response. Infect Immun. 2004;72:2369-78.
- 43. Neva FA, Brown HW. Basic clinical parasitology. Appleton & Lange; 1994. p. 107-144.
- 44. Else KJ, Finkelman FD. Intestinal nematode parasites, cytokines and effector mechanisms. Int J Parasitol. 1998; 28: 1145-58.
- 45. Demeure CE, Rihet P, Abel L, Ouattara M, Bourgois A, Dessein AJ. Resistance to Schistosoma mansoni in humans: influence of the IgE/IgG4 balance and IgG2 in immunity to reinfection after chemotherapy. J Infect Dis. 1993; 168: 1000-8.
- 46. MacDonald A, Araujo MI, Pearce EJ. Immunology of parsitic helminth infection. Infect Immun. 2002; 70:427-33.
- 47. Finkelman FD, Shea-Donohue T, Goldhill J, Sullivan CA, Morris SC, Madden KB, Gause WC, Urban JF Jr. Cytokine regulation of host defense against parasitic gastrointestinal nematodes: lessons from studies with rodent models. Annu Rev Immunol.1997; 15:505-33.
- 48. Butterworth AE. Immunological aspects of human schistosomiasis. Br Med Bull. 1998; 54:357-68.
- 49. Grzych JM, Pearce E, Cheever A, Caulada ZA, Caspar P, Heiny S, et al Egg deposition is the major stimulus for the production of Th2 cytokines in murine schistosomiasis mansoni. J Immunol. 1991; 146: 1322-7.
- 50. Araujo MI, de Jesus AR, Bacellar O, Sabin E, Pearce E, Carvalho EM. Evidence of a T helper type 2 activation in human schistosomiasis. Eur J Immunol. 1996; 26: 1399-403.
- 51. Malaquias LC, Falcão PL, Silveira AM, Gazzinelli G, Prata A, Coffman RL, et al Cytokine regulation of human immune response to Schistosoma mansoni: analysis of the role of IL-4, IL-5 and IL-10 on peripheral blood mononuclear cell responses. Scand J Immunol. 1997; 46: 393-8.
Datas de Publicação
-
Publicação nesta coleção
30 Mar 2005 -
Data do Fascículo
Dez 2004
Histórico
-
Aceito
28 Nov 2004 -
Recebido
15 Nov 2004