Resumos
Compararam-se dois protocolos de curta duração, associados à aplicação de cipionato de estradiol (CE) para sincronização de estro, utilizando-se 12 cabras da raça Saanen, oito multíparas (M) e quatro nulíparas (N), distribuídas em dois tratamentos (T). O T1 (n = 4M e 2N) correspondeu à inserção de esponja impregnada com 60mg de acetato de medroxiprogesterona e o T2 (n= 4M e 2N), à inserção de CIDR-G®. No dia zero (d=0), dia da inserção dos dispositivos intravaginais, foi aplicado nos animais dos dois tratamentos 1mg de CE. Os dispositivos intravaginais permaneceram por cinco dias quando se iniciou a detecção de estro, realizada a cada seis horas. Exames ultra-sonográficos foram feitos diariamente, durante a permanência do dispositivo, e a cada seis horas após a detecção do estro, até 12 horas após a ovulação. Houve regressão folicular com a emergência de uma nova onda no quinto dia da permanência do dispositivo CIDR-G®. As taxas de manifestação de estro e de gestação foram de 5/6 e 1/5 para T1 e de 6/6 e 2/6 para T2, respectivamente. Os intervalos da retirada do dispositivo ao início do estro e da retirada do dispositivo ao fim do estro e a duração do estro foram: 74,0±39,1 e 34,7±15,1 horas (P<0,05), 137,2±42,1 e 90,0±11,2 horas (P<0,05) e 63,2±24,9 e 55,3±17,2 horas (P>0,05), para T1 e T2, respectivamente. Em T1 e T2, os intervalos do início do estro à ovulação foram 50,6±22,6 e 47,3±15,3 horas (P>0,05), do final do estro à ovulação, -12,6±9,1 e -8,0±4,5 horas (P>0,05) e da retirada do dispositivo à ovulação, 124,6±34,1 e 82,0±12,4 horas (P<0,05), respectivamente. O número de ovulações, o diâmetro do folículo ovulatório e a taxa de crescimento dos folículos ovulatórios foram: 1,2±0,45 e 2,33±1,03 (P<0,05), 8,4±2,4 e 6,2±0,1mm (P<0,05) e 2,4±0,97 e 2,9±1,67mm/dia (P>0,05), respectivamente, para T1 e T2. A utilização da esponja e do CIDR-G® associada ao CE foi efetiva em induzir o estro. A ausência de luteólise completa no momento da retirada do dispositivo foi responsável pela grande variação nas características estudadas. Recomenda-se que os dispositivos liberadores de progesterona e seus análogos sintéticos sejam deixados por, no mínimo, sete dias, quando associados ao CE.
caprino; cipionato de estradiol; dispositivos; intravaginal; progesterona; ultra-som
Two short synchronization protocols associated to the estradiol cipionate (EC) for estrus duration were compared. Twelve Saanen breed goats were used (eight multiparous (M) and four nuliparous (N)) in two treatments. T1 (n=4M and 2N) animals received an insertion of sponge intravaginal (ID) impregnated with 60mg of medroxyprogesterone acetate, and T2 (n=4M and 2N) animals received a CIDR-G®. At the device (d=0) insertion time, 1mg of CE was injected in animals from both treatments. On day 5, the ID was removed and the animals were observed for estrus detection every six hours. Ultrasonographic exams were performed daily during the device treatment and at every six hours after the estrus detection, up to 12 hours after the ovulation. A follicular regression occurred at the emergence of a new wave in the fifth day of the permanence of the device CIDR-G® (day 0 = insertion device day). The estrus and pregnancy rates for goats were 5/6 and 1/5 for T1 and 6/6 and 2/6 for T2, respectively. Intervals from removal of the device to the onset of estrus and from removal of the device to the end of estrus, and estrus duration, were 74.0±39.1h and 34.7±15.1h (P<0.05), 137.2±42.1h and 90.0±11.2h (P<0.05), and 63.2±24.9h and 55.3±17.2h (P>0.05), for T1 and T2, respectively. Intervals from the onset of estrus to ovulation, from the end of estrus to ovulation, and from removal of the device to ovulation, were: 50.6±22.6h and 47.3±15.3h (P>0.05), -12.6±9.1h and -8.0±4.5h (P>0.05), and 124.6±34.1 and 82.0±12.4h (P<0.05), for T1 and T2, respectively. The ovulation number, diameter of ovulatory follicle (mm) and the ovulatory follicle growth rate were 1.2±0.45 and 2.33±1.03 (P<0.05), 8.4±2.4 and 6.2±0.1mm (P<0.05) and 2.4±0.97 and 2.9±1.67mm (P>0.05) for T1 and T2, respectively. The use of sponge and CIDR-G® associated with the CE was effective in inducing estrus. The complete absence of luteolysis at the moment of the device withdrawal, showed a great variation for the studied traits. Devices using natural and synthetic progesterone should be maintained on place for at least seven days when associated with 1 mg of CE.
caprine; estradiol cipionate; device; intravaginal; progesterone; ultrasound
MEDICINA VETERINÁRIA
Sincronização de estro em cabras da raça Saanen com esponja intravaginal e CIDR-G®
Estrus synchonization of Saanen goats with intravaginal sponge and CIDR-G®
V.V. MaffiliI; C.A.A. TorresI; J.F. FonsecaII; E.A. MoraesIII; R.A.M. PontesIII
IDepartamento de Zootecnia Universidade Federal de Viçosa Rua P.H. Rolfs, s/n 36570-000 Viçosa, MG
IICentro Nacional de Pesquisa Caprinos EMBRAPA Sobral, CE
IIIEstudante Pós-Graduação UFV Viçosa, MG
RESUMO
Compararam-se dois protocolos de curta duração, associados à aplicação de cipionato de estradiol (CE) para sincronização de estro, utilizando-se 12 cabras da raça Saanen, oito multíparas (M) e quatro nulíparas (N), distribuídas em dois tratamentos (T). O T1 (n = 4M e 2N) correspondeu à inserção de esponja impregnada com 60mg de acetato de medroxiprogesterona e o T2 (n= 4M e 2N), à inserção de CIDR-G®. No dia zero (d=0), dia da inserção dos dispositivos intravaginais, foi aplicado nos animais dos dois tratamentos 1mg de CE. Os dispositivos intravaginais permaneceram por cinco dias quando se iniciou a detecção de estro, realizada a cada seis horas. Exames ultra-sonográficos foram feitos diariamente, durante a permanência do dispositivo, e a cada seis horas após a detecção do estro, até 12 horas após a ovulação. Houve regressão folicular com a emergência de uma nova onda no quinto dia da permanência do dispositivo CIDR-G®. As taxas de manifestação de estro e de gestação foram de 5/6 e 1/5 para T1 e de 6/6 e 2/6 para T2, respectivamente. Os intervalos da retirada do dispositivo ao início do estro e da retirada do dispositivo ao fim do estro e a duração do estro foram: 74,0±39,1 e 34,7±15,1 horas (P<0,05), 137,2±42,1 e 90,0±11,2 horas (P<0,05) e 63,2±24,9 e 55,3±17,2 horas (P>0,05), para T1 e T2, respectivamente. Em T1 e T2, os intervalos do início do estro à ovulação foram 50,6±22,6 e 47,3±15,3 horas (P>0,05), do final do estro à ovulação, -12,6±9,1 e -8,0±4,5 horas (P>0,05) e da retirada do dispositivo à ovulação, 124,6±34,1 e 82,0±12,4 horas (P<0,05), respectivamente. O número de ovulações, o diâmetro do folículo ovulatório e a taxa de crescimento dos folículos ovulatórios foram: 1,2±0,45 e 2,33±1,03 (P<0,05), 8,4±2,4 e 6,2±0,1mm (P<0,05) e 2,4±0,97 e 2,9±1,67mm/dia (P>0,05), respectivamente, para T1 e T2. A utilização da esponja e do CIDR-G® associada ao CE foi efetiva em induzir o estro. A ausência de luteólise completa no momento da retirada do dispositivo foi responsável pela grande variação nas características estudadas. Recomenda-se que os dispositivos liberadores de progesterona e seus análogos sintéticos sejam deixados por, no mínimo, sete dias, quando associados ao CE.
Palavras-chave: caprino, cipionato de estradiol, dispositivos, intravaginal, progesterona, ultra-som
ABSTRACT
Two short synchronization protocols associated to the estradiol cipionate (EC) for estrus duration were compared. Twelve Saanen breed goats were used (eight multiparous (M) and four nuliparous (N)) in two treatments. T1 (n=4M and 2N) animals received an insertion of sponge intravaginal (ID) impregnated with 60mg of medroxyprogesterone acetate, and T2 (n=4M and 2N) animals received a CIDR-G®. At the device (d=0) insertion time, 1mg of CE was injected in animals from both treatments. On day 5, the ID was removed and the animals were observed for estrus detection every six hours. Ultrasonographic exams were performed daily during the device treatment and at every six hours after the estrus detection, up to 12 hours after the ovulation. A follicular regression occurred at the emergence of a new wave in the fifth day of the permanence of the device CIDR-G® (day 0 = insertion device day). The estrus and pregnancy rates for goats were 5/6 and 1/5 for T1 and 6/6 and 2/6 for T2, respectively. Intervals from removal of the device to the onset of estrus and from removal of the device to the end of estrus, and estrus duration, were 74.0±39.1h and 34.7±15.1h (P<0.05), 137.2±42.1h and 90.0±11.2h (P<0.05), and 63.2±24.9h and 55.3±17.2h (P>0.05), for T1 and T2, respectively. Intervals from the onset of estrus to ovulation, from the end of estrus to ovulation, and from removal of the device to ovulation, were: 50.6±22.6h and 47.3±15.3h (P>0.05), -12.6±9.1h and -8.0±4.5h (P>0.05), and 124.6±34.1 and 82.0±12.4h (P<0.05), for T1 and T2, respectively. The ovulation number, diameter of ovulatory follicle (mm) and the ovulatory follicle growth rate were 1.2±0.45 and 2.33±1.03 (P<0.05), 8.4±2.4 and 6.2±0.1mm (P<0.05) and 2.4±0.97 and 2.9±1.67mm (P>0.05) for T1 and T2, respectively. The use of sponge and CIDR-G® associated with the CE was effective in inducing estrus. The complete absence of luteolysis at the moment of the device withdrawal, showed a great variation for the studied traits. Devices using natural and synthetic progesterone should be maintained on place for at least seven days when associated with 1 mg of CE.
Keywords: caprine, estradiol cipionate, device, intravaginal, progesterone, ultrasound
INTRODUÇÃO
De forma geral, a sincronização de estro pode ser efetivamente alcançada pela redução da duração da fase luteal do ciclo estral, utilizando-se prostaglandina ou seus análogos sintéticos, como o cloprostenol, ou pelo alongamento artificial desta fase com o uso de progesterona natural ou progestágenos ou, ainda, associando-se esses elementos. A sincronização por progestágenos baseia-se na manutenção do dispositivo de liberação lenta por tempo que pode variar de cinco a 20 dias (Fonseca, 2002).
Para indução ou sincronização do estro, recomenda-se que o dispositivo permaneça na vagina da cabra por 14 a 17 dias, embora bons resultados tenham sido obtidos utilizando-se o produto por períodos de 18 a 21 dias (Greyling e van der Nest, 2000) ou mesmo cinco, sete ou 12 dias (Rubianes et al., 1998). A utilização de dispositivos por período prolongado (acima de 14 dias) baseia-se no fato de que, independentemente da fase do ciclo estral de sua inserção, haverá tempo suficiente para ocorrer a regressão natural do corpo lúteo, sem que haja necessidade do uso de agentes luteolíticos. Desde os trabalhos iniciais realizados por Christian e Casida (1948), citados por Mapletoft et al. (2000), a progesterona natural e seus análogos sintéticos vêm sendo utilizados sistematicamente por períodos prolongados (>14 dias), com altas taxas de sincronização de estro, porém com baixas taxas de gestação. Recentes estudos demonstraram que a inserção de dispositivos por curto tempo (5 a 6 dias) foi uma alternativa efetiva aos protocolos tradicionais para sincronização de estro (Menchaca e Rubianes, 2001).
Antes de se conhecerem as propriedades luteolíticas da prostaglandina, observou-se que o estradiol promovia a regressão luteal (Wiltbank, 1961, citado por Mapletoft et al., 2000). Estudos posteriores mostraram que, além do efeito luteolítico, o estradiol tinha a capacidade de promover a atresia folicular (Bo et al., 1995), por suprimir a secreção de gonadotrofinas, especialmente quando em presença de nível lúteo de progesterona. O efeito combinado de hormônios esteróides na dinâmica folicular tem sido documentado em bovinos (Bo et al., 1995; Colazo et al., 2003) e ovinos (Meikle et al., 2001). Trabalhos correlacionando o efeito da associação entre esteróides e dinâmica folicular, bem como seu efeito sobre a sincronização de estro são escassos. Assim, o objetivo deste trabalho foi comparar a eficiência da aplicação de esponja intravaginal e de CIDR-G® especialmente quando em presença de níveis lúteos de progesterona.
MATERIAL E MÉTODOS
O estudo foi conduzido numa região localizada a 21º35'S, 43º15'W, a 435 metros de altitude e de clima do tipo Cwa, segundo classificação de Koppen, durante a estação de reprodução dos caprinos, no mês de abril, equivalente ao outono no hemisfério sul.
Cabras da raça Saanen, oito multíparas (M) não lactantes e quatro nulíparas (N), pesando, em média, 52,6±10,9 e 34,7±2,06kg, com escore de condição corporal de 2,28±0,57 (1 = muito magra a 5 = muito gorda) e de 3,4±0,66, respectivamente, foram distribuídas em dois tratamentos.
Os animais foram mantidos em confinamento total em baias coletivas, onde receberam capim napier (Panicum maximum) picado, concentrado comercial1 1 Advanced ® - Agroceres , sal mineral e água à vontade.
Os tratamentos experimentais foram: T1 (n = 6, quatro M e duas N), que correspondeu à sincronização por meio da inserção de esponjas intravaginais2 2 Progespon ®, Syntex S.A Indústria Bioquímica & Farmacêutica, Representante no Brasil Tecnopec impregnadas com 60mg de progesterona sintética (acetato de medroxiprogesterona), associadas a 1mg de cipionato de estradiol3 3 ECP ®, Pharmacia Saúde Animal do Brasil (CE) no dia zero, aplicado via intramuscular, e T2 (n= 6, quatro M e duas N), que diferiu do T1 somente com relação ao dispositivo intravaginal de sincronização, CIDR-G®4 4 Eazi-Breed CIDR-G® Pharmacia Saúde Animal do Brasil Ltda , ambos mantidos por cinco dias.
Logo após a inserção dos dispositivos (dia 0), iniciou-se a avaliação da dinâmica folicular ovariana com o auxílio do ultra-som5 5 Aloka, modelo SSD-500 , acoplado a uma probe de 5 MHz por via transretal. Na presença do dispositivo intravaginal, a avaliação foi feita uma vez ao dia, sempre às 18 horas.
Depois da retirada dos dispositivos intravaginais, as fêmeas foram monitoradas a cada seis horas, no intuito de detectar o início do estro, com o auxílio de um macho cirurgicamente preparado (rufião por translocação peniana). Os sinais de estro observados foram: procura pelo macho, inquietação, vocalização, micção freqüente, batimento de cauda, contração, hiperemia e edema de vulva, descarga de muco vaginal e imobilidade à monta, características consideradas como início do estro.
A inseminação artificial foi realizada depois de detectada a ovulação, utilizando-se sêmen congelado/descongelado com concentração de 10×108 de espermatozóides/ml, oriundos de um mesmo macho e de uma mesma partida (Maffili et al., 2003). Após o descongelamento, observaram-se 75% de motilidade e 3,5 de vigor. Após o teste de termorresistência, por duas horas, a 37º C, a motilidade e o vigor foram 50% e 2,5.
Decorridos 35 dias depois da inseminação artificial, todas as fêmeas foram avaliadas por ultra-sonografia transretal, para detecção precoce da gestação.
Imediatamente após o início do estro, começaram-se os exames ultra-sonográficos a cada seis horas até 12 horas após a detecção da ovulação. As imagens dos ovários foram obtidas por via transretal (Menchaca e Rubianes, 2001), com o auxílio do ultra-som. Os procedimentos utilizados para localização dos ovários foram os mesmos preconizados por Ginther e Kot (1994). O diâmetro, a posição e as características das estruturas ovarianas foram anotados em fichas individuais. A emergência da onda folicular foi definida como sendo a de um pool de pequenos folículos com diâmetro médio entre 3,0 e 4,0mm, que deram origem a um ou mais folículos com diâmetro maior ou igual a 5,0mm. O dia da emergência da onda foi considerado aquele em que o folículo apresentava 3,0mm de diâmetro, seguido por aumento em seu diâmetro para valores iguais ou superiores a 4,0mm (Rubianes et al., 2003). O diâmetro folicular foi obtido pela média da maior distância (mm) entre dois pontos da cavidade antral dos folículos a partir de 2,5mm. A taxa de crescimento do folículo ovulatório (mm/dia) foi obtida por meio da diferença dos diâmetros final e inicial, dividida pelo número de horas e multiplicada por 24. A ovulação foi calculada pela média entre a hora da última visão do folículo ovulatório e a hora de detecção da ovulação.
As amostras de sangue foram coletadas por punção da veia jugular nos dias zero, um, três, cinco, seis, sete e oito em tubos vacuolizados de 15ml com solução anticoagulante (EDTA) e acondicionados em caixa de isopor com banho de gelo. Os tubos foram centrifugados a 3.000rpm durante 15 minutos, para a separação do plasma. Este foi transferido para tubetes plásticos identificados e estocado a -20ºC, até sua análise. A concentração plasmática de progesterona foi determinada por radioimunoensaio de fase sólida (RIA), utilizando-se kits comerciais6 6 Coat-a-count ® progesterone kit DPC Diagnostic Product Co., Los Angeles, CA, USA , seguindo as recomendações do fabricante. A sensibilidade do teste foi 0,03ng/ml, e o coeficiente de variação intra-ensaio de 13,2% para 0,38±0,05ng/ml; 4,0% para 3,7±0,13; e 5,3% para 17,0±0,90ng/ml. O coeficiente interensaio foi de 14,8% para 0,27±0,04ng/ml; 4,3% para 3,5±0,15ng/ml; e 5,6% para 16,0±0,90ng/ml.
Na análise estatística utilizou-se o programa SAEG 8.0 (Sistema... 1997). Para verificar a normalidade e a homogeneidade das variáveis estudadas, utilizaram-se os testes Lilliefors e Cochran e Barttlet, respectivamente. Aplicou-se a análise de variância para observar as diferenças entre as variáveis estudadas. Quando presentes, as diferenças foram testadas usando-se o teste SNK. As variáveis que não apresentaram normalidade ou homogeneidade, mesmo após a transformação logaritímica, foram submetidas à análise não-paramétrica, e as médias comparadas pelo teste Wilcoxon.
RESULTADOS
Na Fig. 1 apresenta-se o comportamento dos folículos durante a permanência do dispositivo. Nos animais dos dois tratamentos, todos os folículos entraram em regressão como resultado da associação entre diferentes fontes de progesterona, seja natural ou sintética e estradiol. Uma vez que não houve efeito de tratamento sobre a ordem de parição (P>0,05), os dados foram analisados em conjunto. Houve queda significativa (P<0,05) no diâmetro folicular do dia zero (dia da inserção do dispositivo) para o dia cinco (dia da retirada).
Os dois maiores diâmetros dos folículos foram: no dia 0, 4,2±2,1 e 3,3±2,2mm; no dia 1 (3,8±2,2 e 2,7±2,3mm); no dia 2, 2,5±2,6 e 1,6±2,3mm; no dia 3, 1,7±2,3 e 1,0±1,9mm; no dia 4, 1,3±1,7 e 0,95±1,4mm; e no dia 5, 0,93±1,4 e 0,7±1,3mm. Em ambos os tratamentos, o dia da emergência folicular deu-se no primeiro dia após a retirada dos dispositivos, de forma sincrônica.
O número e a proporção de cabras com concentração de progesterona abaixo de 1ng/ml são mostrados na Tab. 1.
Uma cabra do T1 não respondeu à sincronização. Nela a concentração plasmática de progesterona foi acima de 1ng/ml, durante todo o período experimental, sendo, portanto, descartada. Das 11 cabras que entraram em estro, oito tiveram luteólise completa após a retirada do dispositivo, sendo três no T1 e cinco no T2. Contudo, deve-se ressaltar que somente uma cabra apresentou luteólise completa durante a permanência da esponja. Uma cabra do T2 não apresentou corpo lúteo funcional no momento da inserção do dispositivo. Ao contrário da esponja, a progesterona liberada pelo CIDR-G® é natural, sendo, portanto, detectada por meio do RIA, não sendo possível determinar, com exatidão, o momento da luteólise durante a permanência desse dispositivo. Das três cabras que não apresentaram luteólise completa no sexto dia, duas tiveram luteólise do sexto para o sétimo dia, e a outra, do sétimo para o oitavo dia.
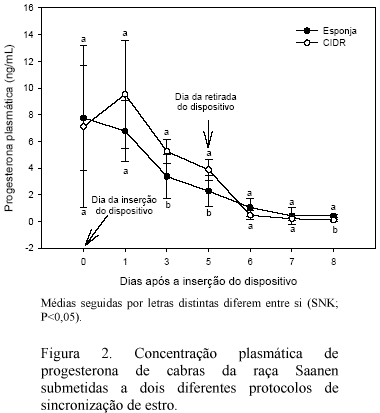
A concentração de progesterona plasmática foi maior nos animais tratados com CIDR-G®, nos dias três (P<0,04), cinco (P<0,02) e oito (P<0,05) (Fig. 2). Essa diferença pode ter sido ocasionda pelo acréscimo na concentração de progesterona provocado pela liberação do CIDR-G®, pois esse produto, ao contrário das esponjas, apresenta progesterona natural, detectável ao RIA.
Das cabras submetidas à sincronização, 91,7% (11/12) manifestaram estro depois da retirada do dispositivo, e 83,3% (5/6) e 100% (6/6) apresentavam-se em estro nos T1 e T2, respectivamente. A taxa de gestação dos animais do T1 foi 20% (1/5), e do T2, 33,3% (2/6) (Tab. 2). Vale mencionar que nenhuma das cabras nulíparas ficou gestante.
O número de animais em estro, a taxa de gestação, o intervalo da retirada do dispositivo ao início do estro, o intervalo da retirada do dispositivo ao final do estro e a duração do estro são apresentados na Tab. 2.
Não houve efeito do tipo de dispositivo sobre a duração do cio (P>0,56). Cabras do T2 entraram em estro (34,7±15,1 horas) mais cedo do que as do T1 (74,0±39,1 horas) (P<0,05). De forma semelhante, as do T2 saíram do estro mais cedo do que as do T1 (P<0,02).
Cabras do T1 apresentaram 1,20±0,45 ovulações, e as do T2, 2,33±1,03 (P<0,01; Tab. 3). O diâmetro médio do folículo ovulatório dos animais do T1 foi 8,4±2,4mm, superior (P<0,01) ao diâmetro das sincronizadas com CIDR-G®, porém a taxa de crescimento do folículo ovulatório não foi influenciada pelo tratamento (P>0,20).
O intervalo entre o início do estro à ovulação (P>0,77) e entre o final do estro à ovulação não foi influenciado (P>0,30) pelos protocolos de sincronização. O intervalo da retirada do dispositivo à ovulação foi, portanto, menor para os animais tratados com CIDR-G® (P<0,02).
DISCUSSÃO
A associação de progesterona e seu análogo sintético com o estradiol foi efetiva em suprimir o crescimento folicular, resultando na emergência de uma nova onda de crescimento em cabras. Resultados semelhantes foram encontrados em bovinos por Bo et al. (1995).
Em bovinos, a aplicação de estrógeno em diferentes fases do ciclo estral promoveu a regressão folicular via feedback negativo sobre a secreção de LH e FSH (Bo et al., 2000). Contudo, deve ser ressaltado que a associação com progestágenos torna-se fundamental, pois o estradiol exógeno pode induzir ovulação se administrado durante a fase não-luteal. Além disso, os progestágenos atuam no nível do eixo hipotalâmico hipofisário, influenciando, de forma negativa, a secreção tônica e o pulsátil de LH, diminuindo sua amplitude e freqüência (Diskin et al., 2002). Sendo o folículo dominante dependente de LH, a inibição provocada pela associação dos esteróides promoverá a regressão do folículo. A ação desses hormônios sobre o pool de folículos recém-recrutados ocorre, portanto, em razão da diminuição do FSH, pois folículos anteriores ao momento da divergência são dependentes do FSH. A união desses fatores levou à regressão da onda e ao recrutamento de um novo pool de folículo.
O controle exógeno da atresia folicular e a sincronização da emergência de uma nova onda podem muitas vezes ser falhos em promover a perfeita sincronia do estro, pois existem mudanças na dependência de gonadotrofinas pelos folículos durante a onda, associados aos mecanismos de controle parácrinos ovariano (Diskin et al., 2002). Esses eventos são de fundamental importância na regulação dos mecanismos que regem a dinâmica folicular. Porém, muitos deles ainda não são compreendidos, o que torna a sincronização da onda muitas vezes falha, acarretando o desenvolvimento de ovócitos imaturos para serem fecundados ou, ainda, inaptos para o perfeito desenvolvimento após a fertilização (Mihm et al., 1994; Austin et al., 1999).
Segundo Bo et al. (1995), a associação de esteróides na sincronização da nova onda depende do estágio em que esses foram administrados. Para os autores, quando progestágenos e estrógenos são aplicados no dia seis e não no dia três, ocorre retardo na emergência da segunda onda folicular, que está, provavelmente, associado à supressão do FSH, responsável pelo recrutamento da onda.
As taxas de ocorrência de estro foram semelhantes às observadas por Oliveira et al. (2001), quando se utilizou o CIDR-G®, e semelhantes às relatadas por Motlomelo et al. (2002), quando se empregaram esponjas intravaginais. De forma geral, dispositivos intravaginais resultam em grande sincronia de estro e quando associados a agentes luteolíticos, em altas taxas de fertilização (Lima et al., 1997). As baixas taxas de gestação observadas podem ter ocorrido pelo fato de a inseminação artificial ter sido realizada depois de confirmada a ovulação, o que poderia ter levado à fecundação de ovócitos já em degeneração. Além disso, alterações no transporte espermático e na capacitação podem afetar a viabilidade do gameta masculino.
O intervalo da retirada do dispositivo ao início do estro observado com esponja foi superior ao intervalo encontrado por Motlomelo et al. (2002) e semelhante ao intervalo quando se usou CIDR-G®. Neste estudo, cabras tratadas com CIDR-G® entraram em estro mais cedo, possivelmente em razão da matriz sólida desse dispositivo (Wheaton et al., 1993), mantendo baixa concentração de progesterona à remoção. Ressalta-se que, ao comprimir a esponja, no ato da retirada, grande quantidade de progesterona é liberada (burst), aumentando a exposição ao progestágeno. A duração do estro em ambos os tratamentos foi superior às médias relatadas por Motlomelo et al. (2002).
Embora não tenha havido diferença entre tratamentos no intervalo do início do estro à ovulação (IIO), neste experimento eles foram superiores aos observados por Fonseca (2002), que sincronizou cabras com prostaglandina (PGF). Aplicações de prostaglandina em momentos aleatórios do ciclo estral podem coincidir com folículos pré-ovulatórios, reduzindo possivelmente o intervalo do início do estro à ovulação (Diskin et al., 2002). Em bovinos, Martinez et al. (2002) observaram que a aplicação de estradiol no momento da inserção do dispositivo liberador de progestágenos levou à atresia folicular. Assim, no momento da retirada do dispositivo, todos os folículos apresentaram tamanhos inferiores a 2,5mm, fato que, associado à taxa de crescimento de 2,2mm/dia, levou ao aumento do IIO. Os diâmetros médios do folículo ovulatório foram semelhantes aos encontrados por Castro et al. (1999).
Três cabras não apresentaram regressão lútea um dia após a retirada do dispositivo (Tab. 1), e, em T1, somente uma cabra mostrou luteólise completa durante a permanência da esponja. No T2, em razão de a progesterona do CIDR-G® ser detectável ao RIA, não foi possível detectar, com exatidão, o momento da luteólise. Ao aplicar CE, objetivou-se a sincronização da emergência da onda e a luteólise. A luteólise induzida pelo CE é conseguida de forma indireta, ou seja, o estradiol induz a formação de receptores para ocitocina no endométrio, permitindo a ligação dessa às células endometriais e a conseqüente secreção de PGF2 (McCracken, 1984). Neste estudo, a grande variabilidade apresentada nas características reprodutivas (IE, DE e IF) foi causada, possivelmente, pela ineficiência do estradiol em promover a luteólise durante as primeiras horas após a aplicação da esponja ou do CIDR-G®.
Em bovinos, Colazo et al. (2003) relataram que o efeito da administração de estradiol pode se prolongar por até 170 horas e que a luteólise provocada por esse agente é lenta e gradual. Thatcher et al. (1986) observaram regressão do corpo lúteo em torno de 97 horas após a aplicação, precedido por traços de 15-ceto-13,14-diidro-prostaglandin F2 (PGFM) na corrente circulatória, antes de ocorrer a luteólise. Peterson et al. (2000) notaram total luteólise nos animais tratados, sete dias após a aplicação do valerato de estradiol. Para os autores, o atraso na luteólise pode ser devido à baixa disponibilidade de estradiol em provocar a luteólise, resultante do tipo de veículo utilizado para diluição do CE.
A presença de progesterona ou de seus análogos sintéticos impede a manifestação do estro e o atraso no desenvolvimento folicular, por inibir a liberação de LH via feedback negativo no eixo hipotalâmico-hipofisário (Burns et al., 1993). Nesta pesquisa, devido ao atraso na luteólise induzida, a concentração de progesterona permaneceu alta por períodos superiores àqueles de permanência do dispositivo, provocando, conseqüentemente, atrasos na manifestação do estro e variação das características reprodutivas e ovulatórias.
Kesler e Garverick (1982) demonstraram que análogos sintéticos do estradiol podem ser responsáveis pela formação de cisto. De fato, verificou-se que uma das cabras desenvolveu cisto folicular. Essa patologia foi acompanhada durante dois meses, sem se observar regressão do cisto. Em bovinos leiteiros, ela pode ser responsável pela redução da fertilidade. Assim, ao se usar estradiol, deve-se ter em mente o efeito colateral de sua administração.
CONCLUSÕES
A utilização do cipionato de estradiol, associado à progesterona natural e ao seu análogo sintético (acetato de medroxiprogesterona), mostrou-se eficiente em sincronizar a emergência da onda folicular. Contudo, devido ao tempo gasto pelo estradiol em provocar a luteólise, recomenda-se que o dispositivo permaneça por sete dias, ao invés de cinco, conforme utilizado neste estudo.
Recebido para publicação em 21 de outubro de 2004
E-mail: vmaffili@cpqgm.fiocruz.br
- AUSTIN, J.E.; MIHM, M.; RYAN, M.P. et al. Effects of duration of dominance of the ovulatory follicle on the onset of estrus and fertility in heifers. J. Anim. Sci., v.77, p.2219-2226, 1999.
- BO, G.A.; ADAMS, G.P.; CACCIA, M. et al. Ovarian follicular wave emergence after treatment with progestogen and estradiol in cattle. Anim. Reprod. Sci., v.39, p.193-204, 1995.
- BO, G.A.; BERGFELDT, D.R.; BROGLIATTI, G.M. et al. Local versus systemic effects of exogenous estradiol-17 on ovarian follicular dynamics in heifers with progestogen implants. Anim. Reprod. Sci., v.59, p.141-157, 2000.
- BURNS, P.D.; SPITZER, J.C.; BRIDGES, W.C. et al. Effects of metoestrus administration of a norgestomet implant and injection of norgestomet and oestradiol valerate on luteinizing hormone release and development and function of corpora lutea in suckled beef cows. J. Anim. Sci., v.71, p.983-988, 1993.
- CASTRO, T.; RUBIANES, E.; MENCHACA, A. et al. Ovarian dynamics, serum estradiol and progesterone concentrations during the interovulatory interval in goats. Theriogenology, v.52, p.399-411, 1999.
- COLAZO, M.G.; KASTELIC, J.P.; MAPLETOFT, R.J. Effects of estradiol cypionate (ECP) on ovarian follicular dynamics, synchrony of ovulation, and fertility in CIDR-G-based, fixed-time AI programs in beef heifers. Theriogenology, v.60, p.855-865, 2003.
- DISKIN, M.G.; AUSTIN, E.J.; ROCHE, J.F. Exogeneous hormonal manipulation of ovarian activity in cattle. Dom. Anim. Endocrinol., v.23, p.211-228, 2002.
- FONSECA, J.F. Controle e perfil hormonal do ciclo estral e performance reprodutiva de cabras alpina e saanen 2002. 107f. Tese (Doutorado em Zootecnia) Departamento de Zootecnia, Universidade Federal de Viçosa, Viçosa, MG.
- GINTHER, O.J.; KOT, K. Follicular dynamics during the ovulatory season in goats. Theriogenology, v.42, p.987-1001, 1994.
- GREYLING, J.P.C.; VAN DER NEST, M. Synchronization of oestrus in goats: dose effect of progestagen. Small Ruminant. Res., v.36, p.201-207, 2000.
- KESLER, D. J.; GARVERICK, H.A. Ovarian cysts in dairy cattle: a review. J. Anim. Sci., v.55, p.1147-1159, 1982.
- LIMA, F.R.G.; ARAÚJO, A.A.; FREITAS. V.J.F. Use of different hormonal treatments for estrus synchronization in native goats of northeastern Brazil. Rev. Bras. Reprod. Anim., v.21, p.136-137, 1997.
- MAFFILI, V.V.; TORRRES, C.A.A.; FURST, R. et al. Fertilidade de sêmen caprino congelado com diluente à base de gema de ovo adicionado de Equex em programas de indução de estro por via hormonal. Arq. Ciên. Vet. Zool. UNIPAR, v.6, p.247, 2003.
- MAPLETOFT, R.J.; BO, G.A.; ADAMS, G.P. Avanços na manipulação do ciclo estral de doadoras e receptoras nos programas de transferência de embriões em bovinos. In: REUNIÃO ANUAL DA SOCIEDADE BRASILEIRA DE TECNOLOGIA DE EMBRIÕES, 15., 2000, Rio Quente. Anais.. Rio Quente: Sociedade Brasileira de Tecnologia de Embriões, 2000. p.24-51.
- MARTINEZ, M.F.; KASTELIC, J.P.; ADAMS, G.P. et al. The use of a progesterone-releasing device (CIDR-G-B) or melengestrol acetate with GnRH, LH, or estradiol benzoate for fixed-time AI in beef heifers. J. Anim. Sci., v.80, p.1746-1751, 2002.
- McCRACKEN, J.A. Update on luteolysis receptor regulation of pulsatile secretion of prostaglandin F2 from the uterus. Res. Reprod., v.16, p.1-2, 1984.
- MEIKLE, A.; FORSBERG, M.; GARÓFALO, E.G. et al. Circulating gonadotrophins and follicular dynamics in anestrous ewes after treatment with estradiol-17b. Anim. Reprod. Sci., v.67, p.79-90, 2001.
- MENCHACA, A.; RUBIANES, E. Effect of high progesterone concentrations during the early luteal phase on the length of the ovulatory cycle of goats. Anim. Reprod. Sci., v.68, p.69-76, 2001.
- MIHM, M.; BAGUISI, A.; BOLAND, M.P. et al. Association between the duration of dominance of the ovulatory follicle and pregnancy rate in cattle. J. Reprod. Fertil., v.102, p.123-130, 1994.
- MOTLOMELO, K.C.; GREYLING, L.M.J.; SCHWALBACH, L.M.J. Synchronisation of oestrus in goats: the use of different progestagen treatments. Small. Ruminant. Res., v.45, p.45-49, 2002.
- OLIVEIRA, M.A.L.; GUIDO, S.I.; LIMA, P.F. Comparison of different protocols used to induce and synchronize estrus cycle. Small. Ruminant. Res., v.40, p.149-153, 2001.
- PETERSON, C.A.; HUHN, J.C.; KESLER, D.J. Norgestomet- and oestradiol valerate-induced luteolysis is dependent upon the uterus. Anim. Reprod. Sci., v.55, p.253-259, 2000.
- RUBIANES, E.; CASTRO, T.; KMAID, S. Estrus response after a short progesterone priming in seasonally anestrous goats. Theriogenology, v.49, p.356, 1998.
- RUBIANES, E.; MENCHACA, A.; CARBAJAL, B. Response of the 1-5 day-aged ovine corpus luteum to prostaglandin F2a. Anim. Reprod. Sci., v.78, p.47-55, 2003.
- SISTEMA de análises estatísticas e genéticas – SAEG. Versão 8.0.Viçosa, MG: 1997. 150p.
- THATCHER, W.W.; TERQUI, M.; THIMONIER, J. Effect of oestradio-17b on peripheral plasma concentration of 15-keto-13,14-dihydro PGF2a and luteolysis in cyclic cattle. Prostaglandins, v.31, p.745-756, 1986.
- WHEATON, J.E.; CARLSON, K.M.; WINDELS, H.F. et al. CIDR: a new progesterone-releasing intravaginal device for induction of estrus and cycle control in sheep and goats. Anim. Reprod. Sci., v.33, p.127-141, 1993.
Datas de Publicação
-
Publicação nesta coleção
08 Dez 2005 -
Data do Fascículo
Out 2005
Histórico
-
Recebido
21 Out 2004