Resumos
Neste trabalho, avaliaram-se as concentrações de ácido fítico, fenóis totais e taninos totais em farelos de canola, girassol e soja, submetidos a diferentes tratamentos químicos, destinados para alimentação de peixes. Os tratamentos foram: A: água acidificada; EMA: etanol P.A. + metanol P.A. + água, na proporção 45:45:10; ET: etanol P.A. acidificado; ETA: etanol P.A. + água acidificada na proporção 70:30; AE: água acidificada e Etanol P.A. utilizados separadamente. No farelo de canola, os tratamentos EMA, ET e ETA aumentaram a concentração de ácido fítico. Os tratamentos AE e ETA foram mais eficientes na remoção de fenóis totais. O teor de taninos foi reduzido em todos os tratamentos, com destaque para ET, ETA e AE. Para o farelo de girassol, os teores de ácido fítico foram reduzidos com os tratamentos A e AE. O tratamento AE removeu a maior quantidade de fenóis totais e taninos totais. Para o farelo de soja, o tratamento A foi o único a reduzir o teor de ácido fítico. O tratamento AE foi mais eficiente na remoção de fenóis totais e taninos totais para esse farelo. O tratamento AE representa a melhor alternativa para extração desses antinutrientes para os farelos de canola, girassol e soja.
ácido fítico; compostos fenólicos; taninos; fatores antinutricionais; fontes proteicas
The phytic acid, phenolic compounds and total tannins contents of canola, sunflower and soybean meals subjected to different chemical treatments were evaluated in this study, aiming its inclusion in fish diets. The treatments were: a) A: acidified water (pH 1.0); b) EMA: ethanol (absolute) + methanol (absolute) + water, (45:45:10 ratio); c) ET: acidified ethanol (absolute) (pH 1.0); d) ETA: ethanol (absolute) + water (70:30 ratio) pH 1.0; e) AE: acidified water (pH 1.0) + ethanol (absolute) used separately. For canola meal, phytic acid content raised when treatments EMA, ET and ETA were used. Treatments AE and ETA were more efficient for reducing phenolic compounds. Total tannins showed reduction under all treatments, but ET, ETA, and AE were more effective. For sunflower meal, A and AE reduced phytic acid content, while the other treatments caused an increase in this antinutrient. Total phenols and tannins were most reduced under AE treatment. For soybean meal, treatment A was the only which reduced phytic acid content. Treatment AE was the best on reducing total phenols and tannins for soybean meal. Treatment AE represents the best alternative for reducing phytic acid, total phenols and total tannins of canola, sunflower and soybean meals.
phytic acid; tannins; phenolic compounds; antinutritional factors; protein sources
ARTIGOS CIENTÍFICOS
PRODUÇÃO ANIMAL
Extração de antinutrientes e aumento da qualidade nutricional dos farelos de girassol, canola e soja para alimentação de peixes
Removal of antinutrients of sunflower, canola and soybean meals and nutritional value improvement as fish feed ingredients
Giovani Taffarel BergaminI, II,1 1 Autor para correspondência. ; Cátia Aline VeiverbergIII; Leila Picolli da SilvaI; Alexandra PrettoI; Luciana Valentim SiqueiraI; João Radünz NetoI
IUniversidade Federal de Santa Maria (UFSM), Departamento de Zootecnia, Laboratório de Piscicultura, Av. Roraima, 1000, Prédio 84, 97105-900, Santa Maria, RS, Brasil. E-mail: giovanitb@gmail.com
IIEmpresa Brasileira de Pesquisa Agropecuária, Embrapa Pesca e Aquicultura, Palmas, TO, Brasil
IIIInstituto Federal de Educação, Ciência e Tecnologia Farroupilha, Campus Júlio de Castilhos, Júlio de Catilhos, RS, Brasil
RESUMO
Neste trabalho, avaliaram-se as concentrações de ácido fítico, fenóis totais e taninos totais em farelos de canola, girassol e soja, submetidos a diferentes tratamentos químicos, destinados para alimentação de peixes. Os tratamentos foram: A: água acidificada; EMA: etanol P.A. + metanol P.A. + água, na proporção 45:45:10; ET: etanol P.A. acidificado; ETA: etanol P.A. + água acidificada na proporção 70:30; AE: água acidificada e Etanol P.A. utilizados separadamente. No farelo de canola, os tratamentos EMA, ET e ETA aumentaram a concentração de ácido fítico. Os tratamentos AE e ETA foram mais eficientes na remoção de fenóis totais. O teor de taninos foi reduzido em todos os tratamentos, com destaque para ET, ETA e AE. Para o farelo de girassol, os teores de ácido fítico foram reduzidos com os tratamentos A e AE. O tratamento AE removeu a maior quantidade de fenóis totais e taninos totais. Para o farelo de soja, o tratamento A foi o único a reduzir o teor de ácido fítico. O tratamento AE foi mais eficiente na remoção de fenóis totais e taninos totais para esse farelo. O tratamento AE representa a melhor alternativa para extração desses antinutrientes para os farelos de canola, girassol e soja.
Palavras-chave: ácido fítico, compostos fenólicos, taninos, fatores antinutricionais, fontes proteicas.
ABSTRACT
The phytic acid, phenolic compounds and total tannins contents of canola, sunflower and soybean meals subjected to different chemical treatments were evaluated in this study, aiming its inclusion in fish diets. The treatments were: a) A: acidified water (pH 1.0); b) EMA: ethanol (absolute) + methanol (absolute) + water, (45:45:10 ratio); c) ET: acidified ethanol (absolute) (pH 1.0); d) ETA: ethanol (absolute) + water (70:30 ratio) pH 1.0; e) AE: acidified water (pH 1.0) + ethanol (absolute) used separately. For canola meal, phytic acid content raised when treatments EMA, ET and ETA were used. Treatments AE and ETA were more efficient for reducing phenolic compounds. Total tannins showed reduction under all treatments, but ET, ETA, and AE were more effective. For sunflower meal, A and AE reduced phytic acid content, while the other treatments caused an increase in this antinutrient. Total phenols and tannins were most reduced under AE treatment. For soybean meal, treatment A was the only which reduced phytic acid content. Treatment AE was the best on reducing total phenols and tannins for soybean meal. Treatment AE represents the best alternative for reducing phytic acid, total phenols and total tannins of canola, sunflower and soybean meals.
Key words: phytic acid, tannins, phenolic compounds, antinutritional factors, protein sources.
INTRODUÇÃO
A nutrição de peixes tem sido objeto de várias pesquisas ao longo dos anos, buscando-se aliar qualidade nutricional da dieta, economicidade e redução de impactos ambientais da atividade. As exigências de proteína para peixes são maiores do que para outros vertebrados, resultando na necessidade de altas taxas de inclusão de farinhas de origem animal, especialmente a farinha de peixe, chegando a níveis em torno de 60% na dieta (WILSON, 2002).
Mesmo com a aquicultura sendo a principal atividade consumidora de farinha de peixe no mundo (60,8% em 2008), desde o ano de 2005, é observada queda na utilização desse ingrediente. Neste ano, 18,7%, em peso, de todo alimento utilizado em aquicultura, era composto por farinha de peixe. Em 2008, esse número reduziu até 12,8%. Segundo dados da FAO (2012), a previsão é que em 2015 e 2020 esses valores cheguem a 7,1% e 4,9%, respectivamente. Essa redução se dará principalmente pela diminuição da oferta de pescado capturado de forma industrial, pelo estabelecimento de restrições e controle sobre a pesca não regulamentada e pelo aumento do uso de ingredientes substitutos tão ou mais eficazes que a farinha de peixe, inclusive com relação ao custo (FAO, 2012).
Nas últimas décadas, devido à probabilidade de escassez de farinha de peixe, diversas instituições de pesquisa, assim como a própria indústria, têm realizado estudos a fim de reduzir a dependência dessa fonte de proteína (HARDY, 2010). Esses estudos estão contribuindo para a geração de informações tanto a respeito da fisiologia da digestão e exigências nutricionais das principais espécies, quanto sobre o processamento de outros ingredientes a serem utilizados em dietas para aquicultura (MWACHIREYA et al., 1999; FUH & CHIANG, 2001; GATLIN III et al., 2007; PICKARDT et al., 2009; OLIVERA-CASTILLO et al., 2011).
As fontes proteicas de origem vegetal caracterizam-se pela disponibilidade constante ao longo do ano, composição homogênea e custo relativamente inferior. Porém, quando utilizadas como único ingrediente proteico na dieta, há desequilíbrio de aminoácidos, comprometendo o desempenho dos animais (JAHAN et al., 2003). Além disso, apresentam fatores antinutricionais que afetam a eficiência de utilização dos nutrientes, prejudicando o crescimento dos peixes.
O farelo de soja é considerado a melhor fonte proteica de origem vegetal, devido ao alto teor proteico, bom perfil de aminoácidos e facilidade de eliminação de fatores antinutricionais termolábeis (MOHANTA et al., 2007). Entretanto, o aumento do consumo de farelo de soja em dietas para outras espécies animais (aves e suínos, por exemplo), tem levado ao aumento do preço desse ingrediente (HARDY, 2010). Além disso, a presença de fatores antinutricionais termoestáveis (ácido fítico, inibidores de protease e polissacarídeos não amiláceos) limitam a inclusão desse ingrediente em dietas para peixes, especialmente nas fases mais exigentes (larvicultura e alevinagem) (GATLIN III et al., 2007).
O farelo de canola contém menos energia, menos proteína e em torno de três vezes mais fibra que o farelo de soja, mas possui mais vitaminas do complexo B e minerais essenciais que o farelo de soja. Além disso, farelo de canola possui duas vezes mais fósforo na forma não-fitato do que o farelo de soja (BELL, 1993). Os principais fatores antinutricionais presentes na canola, além dos glicosinolatos, são os taninos e o ácido fítico. Há evidências indicando inibição das funções digestivas pelos glicosinolatos e taninos, os quais interferem na ação de enzimas digestivas (por complexação), afetando principalmente a hidrólise de proteínas e amido (BELL, 1993).
O farelo de girassol, obtido após a extração do óleo, possui teor proteico em torno de 35 a 50%, dependendo do processo de extração do óleo e da quantidade de cascas presentes no farelo (GONZÁLEZ-PÉREZ & VEREIJKEN, 2007). A utilização dessa fonte proteica em dietas para não-ruminantes e peixes ainda é limitada pela presença de quantidades elevadas de compostos fenólicos, que causam redução da digestibilidade proteica e alteração das propriedades organolépticas e funcionais do farelo (SALGADO et al., 2012).
Atualmente, a escolha de ingredientes de origem vegetal depende basicamente da disponibilidade no mercado, dos custos de aquisição e transporte e da qualidade nutricional. Com o constante aumento no valor da farinha de peixe, os concentrados proteicos de origem vegetal têm se destacado em comparação aos farelos convencionais para a elaboração de dietas para aquicultura, principalmente para espécies de nível trófico elevado (carnívoros). A previsão é de que a demanda de concentrados proteicos de soja, por exemplo, supere 2,8 milhões de toneladas em 2020 para uso em aquicultura (FAO, 2012). Nesse contexto, surge a necessidade de avaliação de tecnologias para o melhor aproveitamento destes alimentos pelos animais.
O objetivo do trabalho foi avaliar a eficiência de diferentes tratamentos químicos para remoção de ácido fítico, fenóis totais e taninos totais em farelos de canola, soja e girassol, visando à utilização em dietas para peixes.
MATERIAL E MÉTODOS
O experimento foi realizado no Laboratório de Piscicultura da Universidade Federal de Santa Maria, RS. Os farelos de canola, girassol e soja, adquiridos em indústria beneficiadora de grãos da região, foram submetidos a diversos tratamentos para a retirada de antinutrientes. Primeiramente, os farelos foram moídos e peneirados em granulometria inferior a 600 µm. Os tratamentos consistiram em lavagem dos farelos com as seguintes soluções: tratamento A: água acidificada (pH 1,0); tratamento EMA: etanol P.A. + metanol P.A. + água, na proporção 45:45:10; tratamento ET: etanol P.A. acidificado (pH 1,0); tratamento ETA: etanol P.A. + água na proporção 70:30 pH 1,0; tratamento AE: água acidificada + Etanol P.A. utilizados individualmente (duas lavagens). Em todos os tratamentos, foi utilizado ácido sulfúrico para diminuir o pH da solução até 1,0.
Todos os farelos foram submetidos à agitação em mesa agitadora (240 movimentos por minuto) durante uma hora nas respectivas soluções, na proporção farelo:solução de 1:10 (peso/volume). Logo após a lavagem, todas as misturas (farelo + solução) tiveram pH ajustado para 7,0, utilizando-se hidróxido de sódio 1N. Então, a fração sólida dos farelos foi filtrada em papel filtro e a fração líquida centrifugada a 2500rpm por 5 minutos para recuperação das partículas em suspensão. A fração sólida recuperada foi seca em estufa de circulação de ar forçada a 60°C por 24 horas, para posterior análise dos fatores antinutricionais. Além dos farelos tratados, foram analisados os farelos não tratados, na forma comercial (subproduto da extração do óleo por prensagem seguida de lavagem com hexano).
Foram feitas as determinações dos teores de ácido fítico, compostos fenólicos totais e taninos totais para todos os tratamentos. A análise de ácido fítico foi feita pela extração com HCl, passando-se por coluna de troca aniônica, com leitura em espectrofotômetro UV/visível, de acordo com a metodologia descrita por LATTA & ESKIN (1980). Compostos fenólicos totais e taninos totais foram determinados de acordo com MAKKAR (2000), utilizando-se banho ultrassônico e ultracentrífuga, com leitura em espectrofotômetro UV/visível.
Os dados coletados foram submetidos a teste de normalidade e análise de variância. As médias, quando significativas, foram comparadas pelo teste de Tukey em nível de 5% de significância (P<0,05). A comparação entre os tratamentos e os farelos não tratados foi feita pelo teste de Dunnett, também a 5% de significância.
RESULTADOS E DISCUSSÃO
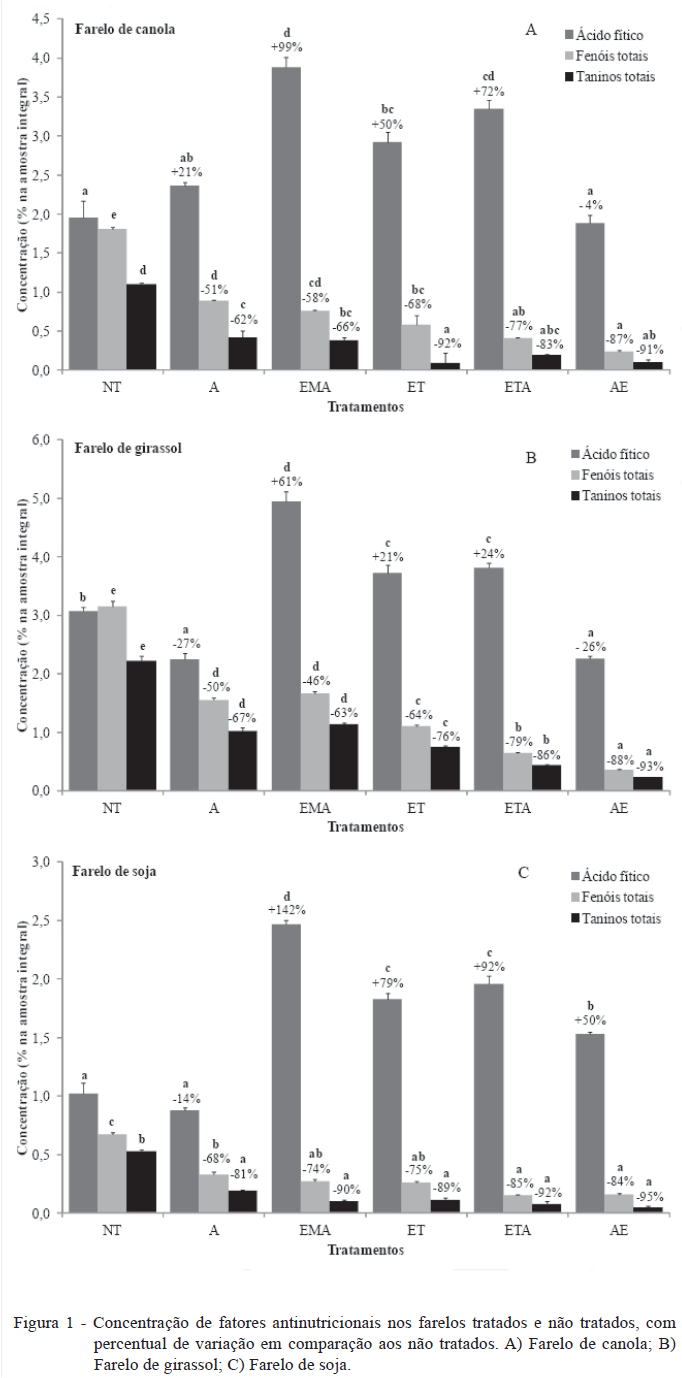
Após o tratamento dos farelos com diferentes soluções, observou-se influência nos teores de antinutrientes em relação aos farelos comerciais (Figura 1). De acordo com o farelo, tipo de tratamento e antinutriente em questão, foram observados efeitos positivos e negativos. Os teores de antinutrientes encontrados nos farelos não tratados mostraram-se semelhantes aos encontrados por outros pesquisadores (BELL, 1993; GATLIN III et al., 2007; NYINA-WAMWIZA et al., 2010; LOMASCOLO et al., 2012).
Todos os tratamentos avaliados apresentaram eficiência de remoção de compostos fenólicos, em comparação com a concentração nos farelos comerciais (Figura 1). No farelo de canola, os tratamentos AE e ETA foram os mais eficientes, com 87% e 77% de redução, respectivamente (Figura 1A). Os tratamentos A e EMA apresentaram os piores resultados para remoção dessa fração. No farelo de girassol, o melhor resultado na extração desse componente foi proporcionado pelo tratamento AE (88%) (Figura 1B). Os teores de fenóis totais no farelo de soja foram menores no tratamento AE, em comparação aos demais (84% de redução em comparação ao farelo comercial não-tratado), seguido em ordem de eficiência pelos tratamentos ETA, ET, EMA e A (Figura 1C). Os compostos fenólicos estão presentes na fração fibra alimentar de diferentes alimentos e podem ser considerados indigeríveis ou pobremente digeríveis, além de causar efeitos adversos na cor, sabor e qualidade nutricional dos ingredientes vegetais utilizados na alimentação de peixes (SILVA & SILVA, 1999).
O teor de taninos totais dos farelos avaliados também foi diminuído em todos os tratamentos. No farelo de canola, destacaram-se os tratamentos ET (92% de redução), AE (91%) e ETA (83%), os quais não diferiram entre si (Figura 1A). Embora os tratamentos A e EMA tenham reduzido o teor de taninos totais, foram menos eficientes em relação aos tratamentos ET e AE, não diferindo do tratamento ETA. No farelo de girassol, o tratamento AE foi o que se mostrou mais eficiente, com redução de 93% do teor de taninos totais em comparação com o farelo comercial. No farelo de soja, todos os tratamentos avaliados apresentaram a mesma eficiência de remoção de taninos totais, variando de 81 a 95% de redução (Figura 1C). Os taninos apresentam grande tendência em formar complexos com proteínas, o que pode explicar a baixa digestibilidade das proteínas de leguminosas, inibição do crescimento e aumento da excreção de nitrogênio fecal em peixes (FRANCIS et al., 2001).
Para o farelo de canola, os teores de ácido fítico obtidos pelos tratamentos A e AE não diferiram significativamente do farelo não tratado. Os tratamentos EMA, ET e ETA causaram aumento na concentração desse antinutriente, sendo o tratamento EMA o que apresentou aumento de 99% em relação ao farelo não tratado (Figura 1A). O aumento pode ter sido ocasionado pela concentração de ácido fítico após o tratamento (lavagem), com a perda de outros componentes, como carboidratos solúveis, polissacarídeos não amiláceos, fibra, saponinas e algumas frações da proteína (MWACHIREYA et al., 1999). Mudanças na composição após tratamentos ácidos também foram observadas por outros autores. FUH & CHIANG (2001) propuseram a retirada de ácido fítico do farelo de arroz com ácido clorídrico, com posterior precipitação da proteína com hidróxido de sódio. Foi observada queda nos teores de Ca, P, K, Mg e 95% de diminuição do ácido fítico. Contudo, o teor de proteína também diminuiu. Mesmo assim, os teores de vitaminas permaneceram praticamente os mesmos. Os autores afirmam que, apesar da diminuição de alguns nutrientes, a permanência e possível reestruturação química de outros, pode causar diferentes efeitos metabólicos e zootécnicos quando o farelo for utilizado para alimentação animal.
Os teores de ácido fítico para o farelo de girassol foram reduzidos pelos tratamentos A (27%) e AE (26%). Os tratamentos ET, ETA e EMA causaram aumento nas concentrações, sendo esse último tratamento o que apresentou os piores resultados (Figura 1B).
Para o farelo de soja, o tratamento A foi o único a diminuir o teor de ácido fítico (14%). Os demais apresentaram acréscimo nos valores, começando pelo tratamento AE, seguido pelos tratamentos ET e ETA, os quais não diferiram entre si e, com o pior resultado, o tratamento EMA (Figura 1C).
Observando-se os resultados, fica evidenciada a necessidade de se conhecer detalhadamente a composição da matéria-prima a ser tratada, para que seja feita a correta escolha do tipo de solvente. Os métodos de extração ou inativação podem ser eficientes para a retirada de um ou vários antinutrientes, mas podem, ao mesmo tempo, comprometer a qualidade nutricional do farelo. Questões como tipo de antinutriente e grupo proteico predominante são fundamentais.
A fração proteica total das leguminosas é uma mistura complexa de globulinas (40-60%), albuminas (8-20%), prolaminas e glutelinas, sendo as duas primeiras os principais componentes, em proporções que oscilam entre as espécies, variedades e/ou cultivares. Apesar de a maior fração ser normalmente constituída por globulinas, esta apresenta menor qualidade nutricional que as albuminas, por isso, a maior proporção da última equivale a uma melhora no valor nutricional da proteína da semente (NEVES et al., 2006). Esse conhecimento se torna importante pelo fato de cada grupo proteico ser solúvel em determinado meio, como água, ácido, entre outros. Tais particularidades devem se refletir na escolha do tratamento, bem como cada farelo necessita de método individual de extração, priorizando-se os antinutrientes mais nocivos. A eficiência de inativação de um tratamento para diversos farelos pode ser diferente, podendo até mesmo aumentar a concentração de determinado antinutriente, devido à interação do solvente com as diferentes frações proteicas, o que pode ser observado no presente trabalho.
Os processos convencionais de extração de proteína podem resultar em produtos de coloração escura com baixa qualidade nutricional. Isso pode ser atribuído à ligação covalente entre compostos fenólicos e grupos reativos da proteína, como cisteína e lisina, durante o processamento em meio alcalino e pelo aquecimento. Os isolados proteicos de oleaginosas são normalmente extraídos em meio alcalino, devido à sua solubilidade (PICKARDT et al., 2009). No presente estudo, não foi observada mudança de coloração dos farelos para nenhum dos tratamentos.
O tratamento AE, que consistiu em lavagem com água em pH 1,0, seguido por lavagem em etanol P.A, foi o que apresentou comportamento mais uniforme entre os três farelos. A purificação da proteína da soja por extração aquosa ou alcoólica (etanol, metanol, álcool isopropílico) permite a obtenção de concentrados e isolados proteicos de soja. Esse processo leva à redução do teor de polissacarídeos não amiláceos, fibra e saponina, aumentando o valor nutricional da fonte. Hajen et al. (1993), apud DREW et al. (2007), trabalhando com farelo de soja e isolado proteico de soja obtidos através de extração aquosa ou com álcool verificaram menor consumo e crescimento em salmões alimentados com dietas contendo fontes tratadas por soluções aquosas. O menor desempenho pode ser atribuído à presença de saponinas, que são compostos termoestáveis solúveis em álcool, mostrando que alguns fatores devem ser tratados individualmente e que o conhecimento de metodologias específicas é muito importante. O tratamento AE, por utilizar as duas formas de extração, além de diminuir os teores de ácido fítico, fenóis e taninos, provavelmente, auxiliou também na retirada de saponinas, mostrando-se como um método adequado e rápido para a extração nos farelos de canola, girassol e soja, para aplicação prática.
Os tratamentos proporcionaram a retirada de grande parte dos antinutrientes, contudo os teores remanescentes ainda podem causar efeito negativo no crescimento de peixes, dependendo da fase de cultivo e da exigência nutricional, principalmente se forem utilizados como única fonte de proteína da dieta (TACON et al., 1997). Ainda assim, é seguro afirmar que os farelos processados tenham ampliado seu potencial de uso. Contudo, a eficiência de utilização dos farelos tratados dependerá da sensibilidade da espécie de peixe enfocada a diferentes tipos e teores de antinutrientes (OLIVERA-CASTILLO et al., 2011), tendo influência direta nos níveis de inclusão desses ingredientes em dietas para peixes.
Muitas vezes, em determinadas regiões, há carência de indústrias produtoras de diferentes concentrados proteicos. Quando há a possibilidade de aquisição através da indústria, normalmente o método utilizado para a obtenção do produto é mantido sob sigilo, o que não é desejável do ponto de vista científico. Assim, esse método se mostra também como boa alternativa para o processamento de matérias-primas em laboratório, com vistas à pesquisa, podendo ser aprimorado e utilizado em outros farelos vegetais para alimentação animal.
O método utilizado se mostra como alternativa para a obtenção de matérias-primas com baixo teor de antinutrientes para experimentação em nutrição de peixes, devendo ser aperfeiçoado e utilizado em outras fontes de proteína, de forma a gerar dados que contribuam para a redução do risco de dependência das farinhas de origem animal.
CONCLUSÃO
O processamento dos farelos através de lavagem com água em pH 1,0, seguido por lavagem em etanol P.A é o mais indicado para a retirada de ácido fítico, fenóis totais e taninos totais dos farelos de canola, girassol e soja, por apresentar comportamento mais uniforme.
AGRADECIMENTOS
Os autores agradecem ao Programa de Pós-graduação em Zootecnia da UFSM e a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela bolsa de doutorado (Giovani Taffarel Bergamin), ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelas bolsas de produtividade em pesquisa (João Radünz Neto e Leila Picolli da Silva), à FAPERGS pela bolsa de iniciação científica (Luciana V. Siqueira) e ao CNPq/Ministério da Pesca e Aquicultura pelo financiamento parcial do projeto.
Recebido 21.01.13
Aprovado 27.04.13
Devolvido pelo autor 04.08.13
CR-2013-0083
- BELL, J.M. Factors affecting the nutritional value of canola meal: a review. Canadian Journal of Animal Science, v.73, p.679-697, 1993. Disponível em: <http://pubs.aic.ca/doi/abs/10.4141/cjas93-075>. Acesso em: 20 jan. 2013. doi: 10.4141/cjas93-075.
- DREW, M.D. et al. A review of processing of feed ingredients to enhance diet digestibility in finfish. Animal Feed Science and Technology, v.138, p.118-136, 2007. Disponível em: <http://dx.doi.org/10.1016/j.anifeedsci.2007.06.019>. Acesso em: 20 jan. 2013. doi: 10.1016/j.anifeedsci.2007.06.019.
- FAO (ORGANIZAÇÃO DAS NAÇÕES UNIDAS PARA AGRICULTURA E ALIMENTAÇÃO). El estado mundial de la pesca y la acuicultura 2012. Disponível em: <http://www.fao.org/docrep/016/i2727s/i2727s00.htm>. Acesso em: 11 set. 2012.
- FUH, W.S.; CHIANG, B.H. Dephytinisation of Rice bran and manufacturing a new food ingredient. Journal of the science of food and agriculture, v.81, p.1419-1425, 2001. Disponível em: <http://onlinelibrary.wiley.com/doi/10.1002/jsfa.962/abstract>. Acesso em: 20 jan. 2013. doi: 10.1002/jsfa.962.
- FRANCIS, G. et al. Antinutritional factors present in plant-derived alternate fish feed ingredients and their effect in fish. Aquaculture, v.199, p.197-227, 2001. Disponível em: <http://dx.doi.org/10.1016/S0044-8486(01)00526-9>. Acesso em: 20 jan. 2013. doi: 10.1016/S0044-8486(01)00526-9.
- GATLIN III, D.M. et al. Expanding the utilization of sustainable plant products in aquafeeds: a review. Aquaculture Research, v.38, p.551-579, 2007. Disponível em: <http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2109.2007.01704.x/abstract>. Acesso em: 20 jan. 2013. doi: 10.1111/j.1365-2109.2007.01704.x.
- GONZÁLEZ-PÉREZ, S.; VEREIJKEN, J.M. Sunflower proteins: overview of their physicochemical, structural and functional properties. Journal of the Science of Food and Agriculture, v.87, n.12, p.2173-2191, 2007. Disponível em: <http://onlinelibrary.wiley.com/doi/10.1002/jsfa.2971/abstract>. Acesso em: 20 jan. 2013. doi: 10.1002/jsfa.2971.
- HARDY, R.W. Utilization of plant proteins in fish diets: effects of global demand and supplies of fishmeal. Aquaculture Research, v.41, p.770-776, 2010. Disponível em: <http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2109.2009.02349.x/abstract>. Acesso em: 20 jan. 2013. doi: 10.1111/j.1365-2109.2009.02349.x.
- JAHAN, P. et al. Improved carp diets based on plant protein sources reduce environmental phosphorus loading. Fisheries Science, v.69, p.219-225, 2003. Disponível em: <http://onlinelibrary.wiley.com/doi/10.1046/j.1444-2906.2003.00611.x/full>. Acesso em: 20 jan. 2013. doi: 10.1046/j.1444-2906.2003.00611.x.
- LATTA, M.; ESKIN, M. A simple and rapid colorimetric method for phytate determination. Journal of Agricultural and Food Chemistry, v.28, n.6, p.1313-1315, 1980. Disponível em: <http://pubs.acs.org/doi/abs/10.1021/jf60232a049>. Acesso em: 20 jan. 2013. doi: 10.1021/jf60232a049.
- LOMASCOLO, A. et al. Rapeseed and sunflower meal: a review on biotechnology status and challenges. Applied Microbiology and Biotechnology, v.95, p.1105-1114, 2012. Disponível em: <http://link.springer.com/content/pdf/10.1007%2Fs00253-012-4250-6>. Acesso em: 20 jan. 2013. doi: 10.1007/s00253-012-4250-6.
- MAKKAR, H.P.S. Quantification of tannins in tree foliage Vienna: FAO/IAEA, 2000. 26p.
- MOHANTA, K.N. et al. Effect of different oil cake sources on growth, nutrient retention and digestibility, muscle nucleic acid content, gut enzyme activities and whole-body composition in silver barb, Puntius gonionotus fingerlings. Aquaculture Research, v.38, p.1702-1713, 2007. Disponível em: <http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2109.2007.01836.x/abstract>. Acesso em: 20 jan. 2013. doi: 10.1111/j.1365-2109.2007.01836.x.
- MWACHIREYA, S.A. et al. Digestibility of canola protein products derived from the physical, enzymatic and chemical processing of commercial canola meal in rainbow trout Oncorhynchus mykiss (Walbaum) held in fresh water. Aquaculture Nutrition, v.5, p.73-82, 1999. Disponível em: <http://onlinelibrary.wiley.com/doi/10.1046/j.1365-2095.1999.00089.x/abstract>. Acesso em: 20 jan. 2013. doi: 10.1046/j.1365-2095.1999.00089.x.
- NEVES, V.A. et al. Isolamento da globulina majoritária, digestibilidade in vivo e in vitro das proteínas do tremoço-doce (Lupinus albus L.) var. multolupa. Ciência e Tecnologia dos Alimentos, v.26, n.4, p.832-840, 2006. Disponível em: <http://dx.doi.org/10.1590/S0101-20612006000400019>. Acesso em: 20 jan. 2013. doi: 10.1590/S0101-20612006000400019.
- NYINA-WAMWIZA, L. et al. Partial or total replacement of fish meal by local agricultural by-products in diets of juvenile African catfish (Clarias gariepinus): growth performance, feed efficiency and digestibility. Aquaculture Nutrition, v.16, p.237-247, 2010. Disponível em: <http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2095.2009.00658.x/abstract>. Acesso em: 20 jan. 2013. doi: 10.1111/j.1365-2095.2009.00658.x.
- OLIVERA-CASTILLO, L. et al. Substitution of fish meal with raw or treated cowpea (Vigna unguiculata L.) Walp (IT86-D719) meal in diets for nile tilapia (Oreochromis niloticus L.) fry. Aquaculture Nutrition, v. 17 p. 101-111, 2011. Disponível em:<http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2095.2009.00739.x/abstract>. Acesso em: 20 jan. 2013. doi: 10.1111/j.1365-2095.2009.00739.x.
- PICKARDT, C. et al. Optimisation of mild-acidic protein extraction from defatted sunflower (Helianthus annus L.) meal. Food Hydrocolloids, v.23, p. 1966-1973, 2009. Disponível em: <http://dx.doi.org/10.1016/j.foodhyd.2009.02.001>. Acesso em: 20 jan. 2013. doi: 10.1016/j.foodhyd.2009.02.001.
- SILVA, M.R.; SILVA, M.A.A.P. Aspectos nutricionais de fitatos e taninos. Revista de Nutrição, v.12, n.1, p.5-19, 1999. Disponível em: <http://dx.doi.org/10.1590/S1415-52731999000100002>. Acesso em: 20 jan. 2013. doi: 10.1590/S1415-52731999000100002.
- SALGADO, P.R. et al. Production and characterization of sunflower (Helianthus annuus L.) protein-enriched products obtained at pilot plant scale. LWT - Food Science and Technology, v.45, p.65-72, 2012. Disponível em: <http://dx.doi.org/10.1016/j.lwt.2011.07.021>. Acesso em: 20 jan. 2013. doi: 10.1016/j.lwt.2011.07.021.
- TACON, A.G.J. Fish meal replacers: review of anti-nutrients within oilseeds and pulses - a limiting factor for the aquafeed green revolution? In: TACON A.; BASURCA B. (Eds.). Feeding tomorrow's fish. Cahiers Options Méditerranéenes, v.22, p.154-182, 1997.
- WILSON, R.P . Aminoacids and protein. In: HALVER, J.E.; HARDY, R.W. Fish nutrition 3.ed. USA: Elsevier Science, 2002. p.144-175.
Datas de Publicação
-
Publicação nesta coleção
13 Set 2013 -
Data do Fascículo
Out 2013
Histórico
-
Recebido
21 Jan 2013 -
Aceito
27 Abr 2013