Resumos
CONTEXTUALIZAÇÃO: A insuficiência cardíaca (IC) acarreta alterações histológicas, metabólicas e funcionais dos músculos inspiratórios. A fraqueza dos músculos inspiratórios, que ocorre em 30% a 50% dos pacientes com IC, associa-se com a redução da capacidade funcional, prejuízos para a qualidade de vida e piora no prognóstico desses indivíduos. OBJETIVOS: Discutir os mecanismos fisiopatológicos que potencialmente explicam o papel da musculatura inspiratória na limitação ao exercício, abordando-se os reflexos que controlam a ventilação e a circulação durante o exercício. MÉTODO: Foram realizadas pesquisas na base de dados PUBMED, utilizando os termos inspiratory muscles, inspiratory muscle training, metaborreflex e chemoreflex e incluindo estudos publicados desde 1980. RESULTADOS: A fraqueza muscular inspiratória está relacionada com intolerância ao exercício e com exacerbação do quimiorreflexo e do metaborreflexo inspiratório na IC. O metaborreflexo inspiratório pode ser atenuado pelo treinamento muscular inspiratório ou pelo treinamento aeróbico, melhorando o desempenho ao exercício. CONCLUSÕES: Os pacientes com IC podem apresentar alterações da função muscular inspiratória associadas com hiperatividade quimiorreflexa e metaborreflexa inspiratória, as quais podem agravar a intolerância ao exercício.
treinamento inspiratório; reabilitação; quimiorreflexo; metaborreflexo; insuficiência cardíaca
BACKGROUND: Heart failure induces histological, metabolic and functional adaptations in the inspiratory muscles. This inspiratory muscle weakness, which occurs in 30% to 50% of the heart failure patients, is associated with reduction in the functional capacity, reduction in the quality of life and with a poor prognosis in these individuals. OBJECTIVES: The objective of this review was to discuss the pathophysiological mechanisms that may explain the role of the inspiratory muscles in the exercise limitation with focus in the reflexes that control the ventilation and the circulation during the exercise. METHOD: We performed searches in the PUBMED database using the terms "inspiratory muscles", "inspiratory muscle training", "metaboreflex" and chemoreflex" and including studies published since 1980. RESULTS: Inspiratory muscle weakness is associated with exercise intolerance and with an exaggerated inspiratory chemoreflex and metaboreflex in heart failure. The inspiratory metaboreflex may be attenuated by the inspiratory muscle training or by the aerobic exercise training improving the exercise performance. CONCLUSIONS: Patients with heart failure may present changes in the inspiratory muscle function associated with inspiratory chemoreflex and metaboreflex hyperactivity, which exacerbate the exercise intolerance.
inspiratory muscle training; rehabilitation; chemoreflex; metaboreflex; heart failure
ILaboratório de Fisiopatologia do Exercício, Serviço de Cardiologia, Hospital de Clínicas, Porto Alegre, RS, Brasil
IIDepartamento de Medicina, Faculdade de Medicina, Universidade Federal do Rio Grande do Sul (UFRGS), Porto Alegre, RS, Brasil
IIILaboratório de Fisiologia, Universidade de Cruz Alta (UNICRUZ), Cruz Alta, RS, Brasil
Correspondência para
RESUMO
CONTEXTUALIZAÇÃO: A insuficiência cardíaca (IC) acarreta alterações histológicas, metabólicas e funcionais dos músculos inspiratórios. A fraqueza dos músculos inspiratórios, que ocorre em 30% a 50% dos pacientes com IC, associa-se com a redução da capacidade funcional, prejuízos para a qualidade de vida e piora no prognóstico desses indivíduos.
OBJETIVOS: Discutir os mecanismos fisiopatológicos que potencialmente explicam o papel da musculatura inspiratória na limitação ao exercício, abordando-se os reflexos que controlam a ventilação e a circulação durante o exercício.
MÉTODO: Foram realizadas pesquisas na base de dados PUBMED, utilizando os termos inspiratory muscles, inspiratory muscle training, metaborreflex e chemoreflex e incluindo estudos publicados desde 1980.
RESULTADOS: A fraqueza muscular inspiratória está relacionada com intolerância ao exercício e com exacerbação do quimiorreflexo e do metaborreflexo inspiratório na IC. O metaborreflexo inspiratório pode ser atenuado pelo treinamento muscular inspiratório ou pelo treinamento aeróbico, melhorando o desempenho ao exercício.
CONCLUSÕES: Os pacientes com IC podem apresentar alterações da função muscular inspiratória associadas com hiperatividade quimiorreflexa e metaborreflexa inspiratória, as quais podem agravar a intolerância ao exercício.
Palavras-chave: treinamento inspiratório; reabilitação; quimiorreflexo; metaborreflexo; insuficiência cardíaca.
Introdução
Há vários anos se propôs que prejuízos na função muscular esquelética periférica contribuem para a fisiopatologia da insuficiência cardíaca (IC). Nesse período, demonstrou-se que as anormalidades da musculatura esquelética limitam a capacidade aeróbica durante o exercício, resultando em acúmulo de metabólitos que levam à sensibilização de receptores musculares chamados metaborreceptores. Essa ativação dos metaborreceptores induz uma resposta reflexa, que resulta em hiperventilação, agravando a sensação de dispneia. Além disso, promove vasoconstrição periférica com redução do fluxo sanguíneo, o que contribui para a redução da tolerância ao exercício na IC1.
Mais recentemente2-7, estudos demonstram que os músculos inspiratórios também podem limitar o desempenho físico ao exercício em indivíduos saudáveis8,9 e em atletas10-13. Da mesma forma, as alterações da musculatura inspiratória desempenham um papel importante na fisiopatologia da limitação ao exercício na IC. Uma dessas alterações trata-se da fraqueza muscular inspiratória, definida arbitrariamente como uma pressão inspiratória máxima (PImáx) menor que 70% do previsto para o sexo e a idade14-16. Os pacientes portadores de fraqueza muscular inspiratória podem apresentar uma redução da capacidade funcional determinada pelo consumo de oxigênio de pico (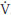 O2 pico)17. Além disso, a força e a resistência muscular inspiratória estão diretamente associadas com o
O2 pico)17. Além disso, a força e a resistência muscular inspiratória estão diretamente associadas com o 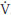 O2 pico em pacientes com infarto agudo do miocárdio recente18, fortalecendo a ideia de que os músculos inspiratórios podem contribuir para a redução da capacidade funcional. Um estudo recente mostra que a força muscular inspiratória também está associada com medidas hemodinâmicas centrais em repouso, incluindo o débito cardíaco, a pressão arterial média pulmonar e a resistência vascular pulmonar de pacientes com IC19. Entretanto, não há correlação entre a força muscular inspiratória e a fração de ejeção do ventrículo esquerdo20. Por fim, a força da musculatura inspiratória, avaliada pela PImáx, apresenta um impacto independente no prognóstico de pacientes com IC20,21.
O2 pico em pacientes com infarto agudo do miocárdio recente18, fortalecendo a ideia de que os músculos inspiratórios podem contribuir para a redução da capacidade funcional. Um estudo recente mostra que a força muscular inspiratória também está associada com medidas hemodinâmicas centrais em repouso, incluindo o débito cardíaco, a pressão arterial média pulmonar e a resistência vascular pulmonar de pacientes com IC19. Entretanto, não há correlação entre a força muscular inspiratória e a fração de ejeção do ventrículo esquerdo20. Por fim, a força da musculatura inspiratória, avaliada pela PImáx, apresenta um impacto independente no prognóstico de pacientes com IC20,21.
Alterações funcionais da musculatura inspiratória podem contribuir para a ativação de reflexos cardiovasculares, que agravam a limitação ao exercício na IC. Dentre esses reflexos, destacam-se a exacerbação do metaborreflexo induzido pelo trabalho da musculatura inspiratória8,9,15 e o aumento das respostas ventilatórias mediadas pelo quimiorreflexo22-24 durante o exercício. Nesta revisão, discutiremos o papel do quimiorreflexo e do metaborreflexo inspiratório na limitação ao exercício na IC.
Quimiorreflexo
O aporte adequado de oxigênio aos tecidos é mantido por ajustes da circulação e da ventilação, mediados por meio da interação complexa de vários sistemas, destacando-se barorreflexo arterial, quimiorreflexo central e periférico, ergorreflexo e reflexo de estiramento pulmonar22. Os quimiorreflexos são os principais mecanismos de controle e regulação das respostas ventilatórias às mudanças de concentração do oxigênio e gás carbônico arterial25. Os quimiorreceptores centrais, localizados na face ventral do bulbo, respondem primariamente às variações na pressão parcial de CO2 (PCO2) no sangue arterial. Os quimiorreceptores periféricos, localizados na artéria carótida comum e na artéria aorta, com aferências para o centro respiratório no bulbo e para o núcleo do trato solitário, respondem primariamente às variações na pressão parcial de O2 (PO2) do sangue arterial22. Dessa forma, ambas as variações na PO2 e na PCO2 resultam em alterações da ventilação pulmonar. Além disso, a ativação do quimiorreflexo central e periférico eleva a atividade nervosa simpática, o que resulta no aumento da frequência cardíaca e da pressão arterial22,26-28. Em contraste, o aumento da ventilação sensibiliza receptores de estiramento localizados nos brônquios, bronquíolos e no pulmão, os quais detectam a excessiva distensão dos pulmões, enviando informações ao grupo respiratório dorsal de neurônios, o que resulta em retroalimentação negativa, impedindo ganhos adicionais de volume inspiratório29. Da mesma forma, o aumento da pressão arterial induzido pelo quimiorreflexo pode ser contrabalançado pela ativação do barorreflexo arterial. A elevação da pressão arterial distende os barorreceptores que transmitem sinais aferentes ao sistema nervoso central, resultando em sinais de retroalimentação negativa à circulação. Dessa forma, ocorre um aumento da atividade vagal eferente e redução da atividade simpática, reduzindo a pressão arterial30. Portanto, o controle reflexo da circulação e da ventilação requer a integração entre diversos sistemas de controle representados na Figura 122.
A sensibilidade quimiorreflexa está anormalmente aumentada em pacientes com IC31-37, resultando em aumento exagerado da ventilação pulmonar37 e da atividade nervosa simpática muscular31. Esse aumento exagerado da sensibilidade quimiorreflexa está associado com redução do sistema de retroalimentação negativa do barorreflexo arterial32. Isso demonstra um prejuízo nos sistemas de ajuste da ventilação e circulação que contribui para a fisiopatologia da IC, pois o aumento da ativação simpática38 resulta em vasoconstrição adrenérgica e aumento da pós-carga ventricular direita e esquerda, sendo que a hiperativação simpática constitui um importante preditor de mortalidade na IC39. Além disso, a exacerbação do quimiorreflexo está relacionada com prejuízos na capacidade funcional36,40. Portanto, pacientes com IC e quimiorreflexo exacerbado poderiam apresentar maior limitação do desempenho ao exercício.
As respostas ventilatórias ao exercício podem ser moduladas pelos quimiorreceptores. Estudos sugerem que ambos, quimiorreflexos periférico e central, contribuem para a ocorrência de hiperventilação ao exercício na IC. De fato, os pacientes com elevação anormal da inclinação ventilação/produção de gás carbônico (
E/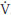 CO2 ) (> 34) apresentam aumento da sensibilidade quimiorreflexa periférica e central41. No entanto, a inibição do quimiorreflexo periférico, via di-hidrocodeína, pode reduzir a inclinação
CO2 ) (> 34) apresentam aumento da sensibilidade quimiorreflexa periférica e central41. No entanto, a inibição do quimiorreflexo periférico, via di-hidrocodeína, pode reduzir a inclinação 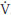 E/
E/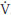 CO2 durante o exercício progressivo42. A hiperventilação durante o exercício pode ainda ser mediada diretamente pelo metaborreflexo esquelético ou o quimiorreflexo central poderia ser indiretamente induzido43, visto que o metaborreflexo é um forte preditor da atividade quimiorreflexa central nos pacientes com IC32. É importante notar que ambos, quimiorreflexo central e resposta ventilatória induzida pelo metaborreflexo muscular esquelético, correlacionam-se significativamente com a inclinação
CO2 durante o exercício progressivo42. A hiperventilação durante o exercício pode ainda ser mediada diretamente pelo metaborreflexo esquelético ou o quimiorreflexo central poderia ser indiretamente induzido43, visto que o metaborreflexo é um forte preditor da atividade quimiorreflexa central nos pacientes com IC32. É importante notar que ambos, quimiorreflexo central e resposta ventilatória induzida pelo metaborreflexo muscular esquelético, correlacionam-se significativamente com a inclinação 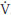 E/
E/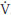 CO2 durante o exercício progressivo na IC41.
CO2 durante o exercício progressivo na IC41.
Outra resposta ventilatória alterada ao exercício, conhecida como ventilação oscilatória ou ventilação periódica44,45, pode estar relacionada com respostas anormais do quimiorreflexo. Um estudo em pacientes com IC demonstrou que a sensibilidade quimiorrreflexa periférica participa da gênese da ventilação oscilatória em repouso46, uma vez que a inibição do quimiorreflexo periférico normaliza a ventilação nesses pacientes. Além da inibição farmacológica do quimiorreflexo, o treinamento muscular inspiratório pode atenuar a ventilação oscilatória ao exercício em pacientes com IC e fraqueza muscular inspiratória. De fato, o treinamento muscular inspiratório a 30% PImáx reduz as oscilações da ventilação em 57%, concomitante com aumento de 115% da força muscular inspiratória14,47. Levando-se em consideração que a ventilação oscilatória pode ser originada pelo quimiorreflexo periférico, testamos a hipótese de que o quimiorreflexo está exacerbado nos pacientes com IC e fraqueza muscular inspiratória. Neste estudo, demonstrou-se uma associação inversa entre quimiorreflexo periférico e PImáx (r=-0,57, p=0,01), ou seja, a fraqueza muscular inspiratória está relacionada com a exacerbação do quimiorreflexo periférico24 apresentado na Figura 2. De fato, o grupo com fraqueza muscular inspiratória apresentou quimiorreflexo periférico maior do que pacientes com força muscular inspiratória preservada24. Dessa forma, a redução da força muscular inspiratória pode agravar a exacerbação da sensibilidade quimiorreflexa em pacientes com IC, o que potencialmente poderia estar relacionado com reduções da capacidade funcional e intolerância ao exercício36,41.
Metaborreflexo muscular inspiratório em indivíduos saudáveis
A ativação do metaborreflexo pela contração dos músculos esqueléticos é amplamente conhecida. Entretanto, apenas na última década, descreveu-se que o metaborreflexo também pode ser ativado pelo trabalho dos músculos respiratórios2-7,48. Inicialmente, demonstrou-se que o exercício físico (intensidade > 85% do consumo máximo de oxigênio [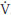 O2 máx]) induz fadiga muscular diafragmática49 até mesmo em atletas de elite50. Em seguida, evidenciou-se que o aumento do trabalho muscular inspiratório (via resistência inspiratória) eleva os níveis de noradrenalina, reduzindo o fluxo sanguíneo da perna durante exercício máximo em bicicleta48. Esses achados originaram a hipótese da existência de um "metaborreflexo inspiratório" ativado durante o exercício físico. Uma teoria confirmada no estudo subsequente comprovou a existência de redistribuição do fluxo sanguíneo dos músculos periféricos ativos para o diafragma, correspondendo a mais de 14 - 16% do débito cardíaco5. Além disso, em protocolo experimental de indução do metaborreflexo inspiratório por meio do esforço inspiratório intenso (resistência inspiratória = 60% da PImáx) e sustentado (razão entre o tempo inspiratório e a duração total do ciclo respiratório [TI/TTot] = 0,70) demonstrou-se que a fadiga muscular inspiratória aumenta a atividade nervosa simpática muscular2 e reduz o fluxo sanguíneo da perna inativa3,4 devido à vasoconstrição adrenérgica. Essa resposta parece ser mediada pela estimulação metabólica de pequenas fibras aferentes dos tipos III e IV provenientes da musculatura respiratória, especialmente do diafragma51. Os efeitos da redistribuição do fluxo sanguíneo durante o trabalho inspiratório fatigante evidenciam a existência do metaborreflexo inspiratório, representado na Figura 352. Dessa forma, a ativação do metaborreflexo inspiratório durante o exercício físico que induz fadiga muscular inspiratória49 pode limitar o desempenho físico12,53 devido à redução do fluxo sanguíneo para os músculos esqueléticos ativos48, exarcebando a fadiga dos músculos periféricos8. Por outro lado, nos indivíduos saudáveis, a redução do trabalho muscular inspiratório, por meio da ventilação mecânica, aumenta o tempo de exercício em 14%6 e atenua a fadiga do quadríceps ao exercício8, provavelmente por inibir o metaborreflexo inspiratório. Além disso, o condicionamento dos músculos inspiratórios poderia minimizar os efeitos da ativação do metaborreflexo inspiratório. Estudos mostram que o treinamento muscular inspiratório, realizado a 50% da PImáx, atenua a resposta pressora54 e reduz a fadiga dos músculos flexores plantares durante ativação do metaborreflexo inspiratório em indivíduos saudáveis9. Esses efeitos do treinamento muscular inspiratório poderiam contribuir para melhorar o desempenho ao exercício. De fato, o treinamento muscular inspiratório prolonga o tempo de exercício em bicicleta, além de reduzir a concentração de lactato ao final do teste de exercício progressivo em indivíduos ativos55. Adicionalmente, o treinamento aeróbico regular também atenua o metaborreflexo inspiratório. Um estudo recente demonstrou que o metaborreflexo inspiratório está atenuado em indivíduos treinados comparados com indivíduos saudáveis sedentários56. De fato, o trabalho muscular inspiratório fatigante induz vasoconstrição periférica com redução do fluxo sanguíneo na panturrilha nos indivíduos sedentários, mas mantém-se praticamente inalterado nos indivíduos treinados aerobicamente (Figura 4)56. Esse efeito do treinamento aeróbico sobre o metaborreflexo inspiratório provavelmente está relacionado com o aumento da capacidade oxidativa57, da força dos músculos inspiratórios58 e da resistência à fadiga do diafragma59. Alternativamente, a aplicação de estimulação elétrica nervosa transcutânea (TENS) na região cervicotorácica atenua o metaborreflexo muscular esquelético, provavelmente devido ao bloqueio da atividade nervosa simpática em jovens e em idosos, conforme demonstrado recentemente60. Dessa forma, a aplicação de TENS na região cervicotorácica poderia, possivelmente, atenuar o metaborreflexo inspiratório com repercussões no desempenho físico, mas essa hipótese ainda precisa ser mais bem investigada.
O2 máx]) induz fadiga muscular diafragmática49 até mesmo em atletas de elite50. Em seguida, evidenciou-se que o aumento do trabalho muscular inspiratório (via resistência inspiratória) eleva os níveis de noradrenalina, reduzindo o fluxo sanguíneo da perna durante exercício máximo em bicicleta48. Esses achados originaram a hipótese da existência de um "metaborreflexo inspiratório" ativado durante o exercício físico. Uma teoria confirmada no estudo subsequente comprovou a existência de redistribuição do fluxo sanguíneo dos músculos periféricos ativos para o diafragma, correspondendo a mais de 14 - 16% do débito cardíaco5. Além disso, em protocolo experimental de indução do metaborreflexo inspiratório por meio do esforço inspiratório intenso (resistência inspiratória = 60% da PImáx) e sustentado (razão entre o tempo inspiratório e a duração total do ciclo respiratório [TI/TTot] = 0,70) demonstrou-se que a fadiga muscular inspiratória aumenta a atividade nervosa simpática muscular2 e reduz o fluxo sanguíneo da perna inativa3,4 devido à vasoconstrição adrenérgica. Essa resposta parece ser mediada pela estimulação metabólica de pequenas fibras aferentes dos tipos III e IV provenientes da musculatura respiratória, especialmente do diafragma51. Os efeitos da redistribuição do fluxo sanguíneo durante o trabalho inspiratório fatigante evidenciam a existência do metaborreflexo inspiratório, representado na Figura 352. Dessa forma, a ativação do metaborreflexo inspiratório durante o exercício físico que induz fadiga muscular inspiratória49 pode limitar o desempenho físico12,53 devido à redução do fluxo sanguíneo para os músculos esqueléticos ativos48, exarcebando a fadiga dos músculos periféricos8. Por outro lado, nos indivíduos saudáveis, a redução do trabalho muscular inspiratório, por meio da ventilação mecânica, aumenta o tempo de exercício em 14%6 e atenua a fadiga do quadríceps ao exercício8, provavelmente por inibir o metaborreflexo inspiratório. Além disso, o condicionamento dos músculos inspiratórios poderia minimizar os efeitos da ativação do metaborreflexo inspiratório. Estudos mostram que o treinamento muscular inspiratório, realizado a 50% da PImáx, atenua a resposta pressora54 e reduz a fadiga dos músculos flexores plantares durante ativação do metaborreflexo inspiratório em indivíduos saudáveis9. Esses efeitos do treinamento muscular inspiratório poderiam contribuir para melhorar o desempenho ao exercício. De fato, o treinamento muscular inspiratório prolonga o tempo de exercício em bicicleta, além de reduzir a concentração de lactato ao final do teste de exercício progressivo em indivíduos ativos55. Adicionalmente, o treinamento aeróbico regular também atenua o metaborreflexo inspiratório. Um estudo recente demonstrou que o metaborreflexo inspiratório está atenuado em indivíduos treinados comparados com indivíduos saudáveis sedentários56. De fato, o trabalho muscular inspiratório fatigante induz vasoconstrição periférica com redução do fluxo sanguíneo na panturrilha nos indivíduos sedentários, mas mantém-se praticamente inalterado nos indivíduos treinados aerobicamente (Figura 4)56. Esse efeito do treinamento aeróbico sobre o metaborreflexo inspiratório provavelmente está relacionado com o aumento da capacidade oxidativa57, da força dos músculos inspiratórios58 e da resistência à fadiga do diafragma59. Alternativamente, a aplicação de estimulação elétrica nervosa transcutânea (TENS) na região cervicotorácica atenua o metaborreflexo muscular esquelético, provavelmente devido ao bloqueio da atividade nervosa simpática em jovens e em idosos, conforme demonstrado recentemente60. Dessa forma, a aplicação de TENS na região cervicotorácica poderia, possivelmente, atenuar o metaborreflexo inspiratório com repercussões no desempenho físico, mas essa hipótese ainda precisa ser mais bem investigada.
Metaborreflexo inspiratório em indivíduos com insuficiência cardíaca
O metaborreflexo inspiratório pode limitar o desempenho ao exercício principalmente nos pacientes com IC que apresentam fraqueza muscular inspiratória15. De fato, a fraqueza da musculatura inspiratória, frequentemente encontrada em pacientes com IC16,61-63, pode estar implicada na intolerância ao exercício. Além disso, a redução da oxigenação da musculatura inspiratória mediada pelo exercício físico agudo nos pacientes com IC64 poderia aumentar o trabalho ventilatório e exacerbar o metaborreflexo muscular inspiratório, que conforme citado anteriormente, limita a tolerância ao exercício devido à redução da perfusão dos músculos locomotores.
Dessa forma, as estratégias que reduzem o trabalho muscular inspiratório e atenuam o metaborreflexo inspiratório poderiam melhorar a tolerância ao exercício. De fato, a redução do trabalho muscular inspiratório, por meio de uma ventilação não invasiva no modo ventilação assistida proporcional, pode melhorar o desempenho físico em pacientes com IC. Recentemente, demonstrou-se que essa intervenção melhora a oxigenação da microcirculação muscular periférica, o que pode ser compatível com a melhora do fluxo sanguíneo local65. Esses achados foram recentemente confirmados por Olson et al.66, sendo que a redução do trabalho muscular inspiratório aumentou o fluxo sanguíneo na perna e o débito cardíaco apenas em pacientes com IC, permanecendo inalterado nos controles saudáveis. Isso significa que os pacientes com IC estão mais suceptíveis à intolerância durante o exercício devido aos efeitos da ativação do metaborreflexo pelo trabalho muscular inspiratório, de forma que o treinamento muscular inspiratório atenua o metaborreflexo inspiratório em pacientes com IC e fraqueza da musculatura inspiratória (Figura 5)15. Esses efeitos do treinamento muscular inspiratório podem contribuir para a melhora das respostas cardiorrespiratórias, da capacidade funcional e da tolerância ao exercício nos pacientes com IC14. Um estudo recente confirmou os achados de melhora na tolerância ao exercício após o treinamento muscular inspiratório67, sendo que a melhora na capacidade funcional ocorre inclusive nos pacientes com IC portadores de aparelho de assistência ventricular esquerda68. Dessa forma, o condicionamento dos músculos inspiratórios via treinamento muscular inspiratório poderia atenuar o metaborreflexo inspiratório com possíveis benefícios para a melhora da tolerância ao exercício para pacientes com IC. Portanto, as intervenções que atenuam a ativação do metaborreflexo inspiratório podem ser benéficas para pacientes que apresentam intolerância ao exercício, incluindo os portadores de doença pulmonar obstrutiva crônica. Em modelo animal de IC, demonstrou-se ainda que o treinamento muscular inspiratório melhora a função hemodinâmica, a mecânica respiratória e o controle autonômico cardiovascular69.
Alguns estudos sugerem que a ventilação não invasiva poderia atenuar transitoriamente a ativação do metaborreflexo inspiratório devido à redução do trabalho muscular inspiratório nos pacientes com doença pulmonar obstrutiva crônica. No estudo de Borghi-Silva et al.70, a ventilação positiva bilevel na via aérea melhorou a saturação periférica de O2 e reduziu a fadigabilidade do músculo quadríceps durante exercício isocinético. Esses dados foram reforçados por um estudo que demonstrou que a redução do trabalho muscular respiratório, via inalação de uma mistura contendo gás hélio a 79%, contrabalançado com oxigênio, melhorou a tolerância ao exercício em pacientes com doença pulmonar obstrutiva crônica que realizaram um protocolo de exercício com carga constante e de alta intensidade71. Além disso, a utilização de pressão positiva de suporte aumenta a resistência ao exercício nesses pacientes72. Dessa forma, a assistência ventilatória não invasiva poderia auxiliar na manutenção do treinamento físico de pacientes que apresentam limitações graves ao exercício relacionadas à doença pulmonar obstrutiva crônica, provavelmente pela atenuação do metaborreflexo inspiratório73.
Implicações para a prática do fisioterapeuta
O treinamento muscular inspiratório melhora a capacidade funcional e a qualidade de vida nos pacientes com IC e fraqueza muscular inspiratória14. Esses achados foram confirmados em um estudo recente que investigou os efeitos do treinamento muscular inspiratório na IC e que apresentou, em sua amostra, a grande maioria de pacientes com fraqueza muscular inspiratória67. Além disso, a associação de treinamento muscular inspiratório com treinamento aeróbico promove efeitos adicionais sobre o 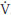 O2 pico nos pacientes com fraqueza muscular inspiratória58. Ensaios clínicos controlados e randomizados com maior tamanho amostral poderiam investigar os efeitos isolados74 e comparados entre treinamento aeróbico e treinamento muscular inspiratório em pacientes portadores de fraqueza muscular inspiratória.
O2 pico nos pacientes com fraqueza muscular inspiratória58. Ensaios clínicos controlados e randomizados com maior tamanho amostral poderiam investigar os efeitos isolados74 e comparados entre treinamento aeróbico e treinamento muscular inspiratório em pacientes portadores de fraqueza muscular inspiratória.
Portanto, recomenda-se ao fisioterapeuta avaliar rotineiramente a força muscular inspiratória de pacientes com IC, visando identificar pacientes com fraqueza muscular inspiratória, os quais poderiam ser beneficiados pelo treinamento da musculatura inspiratória.
Conclusão
Os pacientes com IC podem apresentar alterações da função muscular inspiratória associadas com hiperatividade quimiorreflexa e metaborreflexa inspiratória, as quais podem agravar a intolerância ao exercício.
Referências
- 1. Clark AL, Poole-Wilson PA, Coats AJ. Exercise limitation in chronic heart failure: central role of the periphery. J Am Coll Cardiol. 1996;28(5):1092-102.
- 2. St Croix CM, Morgan BJ, Wetter TJ, Dempsey JA. Fatiguing inspiratory muscle work causes reflex sympathetic activation in humans. J Physiol. 2000;529(Pt 2):493-504.
- 3. Sheel AW, Derchak PA, Morgan BJ, Pegelow DF, Jacques AJ, Dempsey JA. Fatiguing inspiratory muscle work causes reflex reduction in resting leg blood flow in humans. J Physiol. 2001;537(Pt 1):277-89.
- 4. Sheel AW, Derchak PA, Pegelow DF, Dempsey JA. Threshold effects of respiratory muscle work on limb vascular resistance. Am J Physiol Heart Circ Physiol. 2002;282(5):H1732-8.
- 5. Harms CA, Wetter TJ, McClaran SR, Pegelow DF, Nickele GA, Nelson WB, et al. Effects of respiratory muscle work on cardiac output and its distribution during maximal exercise. J Appl Physiol. 1998;85(2):609-18.
- 6. Harms CA, Wetter TJ, St Croix CM, Pegelow DF, Dempsey JA. Effects of respiratory muscle work on exercise performance. J Appl Physiol. 2000;89(1):131-8.
- 7. Derchak PA, Sheel AW, Morgan BJ, Dempsey JA. Effects of expiratory muscle work on muscle sympathetic nerve activity. J Appl Physiol. 2002;92(4):1539-52.
- 8. Romer LM, Lovering AT, Haverkamp HC, Pegelow DF, Dempsey JA. Effect of inspiratory muscle work on peripheral fatigue of locomotor muscles in healthy humans. J Physiol. 2006;571(Pt 2):425-39.
- 9. McConnell AK, Lomax M. The influence of inspiratory muscle work history and specific inspiratory muscle training upon human limb muscle fatigue. J Physiol. 2006;577(Pt 1):445-57.
- 10. Dempsey JA, Sheel AW, St Croix CM, Morgan BJ. Respiratory influences on sympathetic vasomotor outflow in humans. Respir Physiol Neurobiol. 2002;130(1):3-20.
- 11. Harms CA. Insights into the role of the respiratory muscle metaboreflex. J Physiol. 2007;584(Pt 3):711.
- 12. Dempsey JA, McKenzie DC, Haverkamp HC, Eldridge MW. Update in the understanding of respiratory limitations to exercise performance in fit, active adults. Chest. 2008;134(3):613-22.
- 13. Romer LM, Polkey MI. Exercise-induced respiratory muscle fatigue: implications for performance. J Appl Physiol. 2008;104(3):879-88.
- 14. Dall'Ago P, Chiappa GR, Guths H, Stein R, Ribeiro JP. Inspiratory muscle training in patients with heart failure and inspiratory muscle weakness: a randomized trial. J Am Coll Cardiol. 2006;47(4):757-63.
- 15. Chiappa GR, Roseguini BT, Vieira PJ, Alves CN, Tavares A, Winkelmann ER, et al. Inspiratory muscle training improves blood flow to resting and exercising limbs in patients with chronic heart failure. J Am Coll Cardiol. 2008;51(17):1663-71.
- 16. Ribeiro JP, Chiappa GR, Neder JA, Frankenstein L. Respiratory muscle function and exercise intolerance in heart failure. Curr Heart Fail Rep. 2009;6(2):95-101.
- 17. Greutmann M, Le TL, Tobler D, Biaggi P, Oechslin EN, Silversides CK, et al. Generalised muscle weakness in young adults with congenital heart disease. Heart. 2011;97(14):1164-8.
- 18. Neves LM, Karsten M, Neves VR, Beltrame T, Borghi-Silva A, Catai AM. Relationship between inspiratory muscle capacity and peak exercise tolerance in patients post-myocardial infarction. Heart Lung. 2012;41(2):137-45.
- 19. Filusch A, Ewert R, Altesellmeier M, Zugck C, Hetzer R, Borst MM, et al. Respiratory muscle dysfunction in congestive heart failure--the role of pulmonary hypertension. Int J Cardiol. 2011;150(2):182-5.
- 20. Meyer FJ, Borst MM, Zugck C, Kirschke A, Schellberg D, Kübler W, et al. Respiratory muscle dysfunction in congestive heart failure: clinical correlation and prognostic significance. Circulation. 2001;103(17):2153-8.
- 21. Frankenstein L, Nelles M, Meyer FJ, Sigg C, Schellberg D, Remppis BA, et al. Validity, prognostic value and optimal cutoff of respiratory muscle strength in patients with chronic heart failure changes with beta-blocker treatment. Eur J Cardiovasc Prev Rehabil. 2009;16(4):424-9.
- 22. Schmidt H, Francis DP, Rauchhaus M, Werdan K, Piepoli MF. Chemo- and ergoreflexes in health, disease and ageing. Int J Cardiol. 2005;98(3):369-78.
- 23. Tumminello G, Guazzi M, Lancellotti P, Piérard LA. Exercise ventilation inefficiency in heart failure: pathophysiological and clinical significance. Eur Heart J. 2007;28(6):673-8.
- 24. Callegaro CC, Martinez D, Ribeiro PA, Brod M, Ribeiro JP. Augmented peripheral chemoreflex in patients with heart failure and inspiratory muscle weakness. Respir Physiol Neurobiol. 2010;171(1):31-5.
- 25. Guimarães GV, Belli JFC, Bacal F, Bocchi EA. Behavior of central and peripheral chemoreflexes in heart failure. Arq Bras Cardiol. 2011;96(2):161-7.
- 26. Somers VK, Mark AL, Zavala DC, Abboud FM. Influence of ventilation and hypocapnia on sympathetic nerve responses to hypoxia in normal humans. J Appl Physiol. 1989;67(5):2095-100.
- 27. Somers VK, Mark AL, Zavala DC, Abboud FM. Contrasting effects of hypoxia and hypercapnia on ventilation and sympathetic activity in humans. J Appl Physiol. 1989;67(5):2101-6.
- 28. Marshall JM. Peripheral chemoreceptors and cardiovascular regulation. Physiol Rev. 1994;74(3):543-94.
- 29. Guyton AC, Hall JE. Tratado de fisiologia médica. 11Ş Ed. Rio de Janeiro: Editora Elsevier; 2006.
- 30. Callegaro CC, Taylor JA. Age-related effects of vagotonic atropine on cardiovagal baroreflex gain. Neurobiol Aging. 2012;33(2):368-74.
- 31. Di Vanna A, Braga AM, Laterza MC, Ueno LM, Rondon MU, Barretto AC, et al. Blunted muscle vasodilatation during chemoreceptor stimulation in patients with heart failure. Am J Physiol Heart Circ Physiol. 2007;293(1):H846-52.
- 32. Ponikowski PP, Chua TP, Francis DP, Capucci A, Coats AJ, Piepoli MF. Muscle ergoreceptor overactivity reflects deterioration in clinical status and cardiorespiratory reflex control in chronic heart failure. Circulation. 2001;104(19):2324-30.
- 33. Chua TP, Clark AL, Amadi AA, Coats AJ. Relation between chemosensitivity and the ventilatory response to exercise in chronic heart failure. J Am Coll Cardiol. 1996;27(3):650-7.
- 34. Sun SY, Wang W, Zucker IH, Schultz HD. Enhanced peripheral chemoreflex function in conscious rabbits with pacing-induced heart failure. J Appl Physiol. 1999;86(4):1264-72.
- 35. Chua TP, Ponikowski PP, Harrington D, Chambers J, Coats AJ. Contribution of peripheral chemoreceptors to ventilation and the effects of their suppression on exercise tolerance in chronic heart failure. Heart. 1996;76(6):483-9.
- 36. Chua TP, Ponikowski P, Webb-Peploe K, Harrington D, Anker SD, Piepoli M, et al. Clinical characteristics of chronic heart failure patients with an augmented peripheral chemoreflex. Eur Heart J. 1997;18(3):480-6.
- 37. Narkiewicz K, Pesek CA, van de Borne PJ, Kato M, Somers VK. Enhanced sympathetic and ventilatory responses to central chemoreflex activation in heart failure. Circulation. 1999;100(3):262-7.
- 38. Ciarka A, Najem B, Cuylits N, Leeman M, Xhaet O, Narkiewicz K, et al. Effects of peripheral chemoreceptors deactivation on sympathetic activity in heart transplant recipients. Hypertension. 2005;45(5):894-900.
- 39. Munhoz RT, Negrão CE, Barretto AC, Ochiai ME, Cardoso JN, Morgado PC, et al. Microneurography and venous occlusion plethysmography in heart failure: correlation with prognosis. Arq Bras Cardiol. 2009;92(1):46-53.
- 40. Ponikowski P, Chua TP, Anker SD, Francis DP, Doehner W, Banasiak W, et al. Peripheral chemoreceptor hypersensitivity: an ominous sign in patients with chronic heart failure. Circulation. 2001;104(5):544-9.
- 41. Ponikowski P, Francis DP, Piepoli MF, Davies LC, Chua TP, Davos CH, et al. Enhanced ventilatory response to exercise in patients with chronic heart failure and preserved exercise tolerance: marker of abnormal cardiorespiratory reflex control and predictor of poor prognosis. Circulation. 2001;103(7):967-72.
- 42. Chua TP, Harrington D, Ponikowski P, Webb-Peploe K, Poole-Wilson PA, Coats AJ. Effects of dihydrocodeine on chemosensitivity and exercise tolerance in patients with chronic heart failure. J Am Coll Cardiol. 1997;29(1):147-52.
- 43. Piepoli MF, Ponikowski PP, Volterrani M, Francis D, Coats AJ. Aetiology and pathophysiological implications of oscillatory ventilation at rest and during exercise in chronic heart failure. Do Cheyne and Stokes have an important message for modern-day patients with heart failure? Eur Heart J. 1999;20(13):946-53.
- 44. Ribeiro JP, Knutzen A, Rocco MB, Hartley H, Colucci WS. Periodic Breathing during exercise in severe heart failure. Reversal with milrinone or cardiac transplantation. Chest. 1987;92(3):555-6.
- 45. Ribeiro JP, Stein R, Chiappa GR. Beyond peak oxygen uptake: new prognostic markers from gas exchange exercise tests in chronic heart failure. J Cardiopulm Rehabil. 2006;26(2):63-71.
- 46. Ponikowski P, Anker SD, Chua TP, Francis D, Banasiak W, Poole-Wilson PA, et al. Oscillatory breathing patterns during wakefulness in patients with chronic heart failure: clinical implications and role of augmented peripheral chemosensitivity. Circulation. 1999;100(24):2418-24.
- 47. Stein R, Chiappa GR, Güths H, Dall'Ago P, Ribeiro JP. Inspiratory muscle training improves oxygen uptake efficiency slope in patients with chronic heart failure. J Cardiopulm Rehabil Prev. 2009;29(6):392-5.
- 48. Harms CA, Babcock MA, McClaran SR, Pegelow DF, Nickele GA, Nelson WB, et al. Respiratory muscle work compromises leg blood flow during maximal exercise. J Appl Physiol. 1997;82(5):1573-83.
- 49. Johnson BD, Babcock MA, Suman OE, Dempsey JA. Exercise-induced diaphragmatic fatigue in healthy humans. J Physiol. 1993;460:385-405.
- 50. Babcock MA, Pegelow DF, Johnson BD, Dempsey JA. Aerobic fitness effects on exercise-induced low-frequency diaphragm fatigue. J Appl Physiol. 1996;81(5):2156-64.
- 51. Hill JM. Discharge of group IV phrenic afferent fibers increases during diaphragmatic fatigue. Brain Res. 2000;856(1-2):240-4.
- 52. Dempsey JA, Romer L, Rodman J, Miller J, Smith C. Consequences of exercise-induced respiratory muscle work. Respir Physiol Neurobiol. 2006;151(2-3):242-50.
- 53. Dempsey JA, Amann M, Romer LM, Miller JD. Respiratory system determinants of peripheral fatigue and endurance performance. Med Sci Sports Exerc. 2008;40(3):457-61.
- 54. Witt JD, Guenette JA, Rupert JL, McKenzie DC, Sheel AW. Inspiratory muscle training attenuates the human respiratory muscle metaboreflex. J Physiol. 2007;584(Pt 3):1019-28.
- 55. Spengler CM, Roos M, Laube SM, Boutellier SML. Decreased exercise blood lactate concentrations after respiratory endurance training in humans. Eur J Appl Physiol. 1999;79(4):299-305.
- 56. Callegaro CC, Ribeiro JP, Tan CO, Taylor JA. Attenuated inspiratory muscle metaboreflex in endurance-trained individuals. Respir Physiol Neurobiol. 2011;177(1):24-9.
- 57. Powers SK, Criswell D, Lieu FK, Dodd S, Silverman H. Exercise-induced cellular alterations in the diaphragm. Am J Physiol. 1992;263(5 Pt 2):R1093-8.
- 58. Winkelmann ER, Chiappa GR, Lima COC, Viecili PRN, Stein R, Ribeiro JP. Addition of inspiratory muscle training to aerobic training improves cardiorespiratory responses to exercise in patients with heart failure and inspiratory muscle weakness. Am Heart J. 2009;158(5):768.e1-7.
- 59. Vrabas IS, Dodd SL, Powers SK, Hughes M, Coombes J, Fletcher L, et al. Endurance training reduces the rate of diaphragm fatigue in vitro. Med Sci Sports Exerc. 1999;31(11):1605-12.
- 60. Vieira PJC, Ribeiro JP, Cipriano CJr, Umpierre D, Cahalin LP, Moraes RS, et al. Effect of transcutaneous electrical nerve stimulation on muscle metaboreflex in healthy young and older subjects. Eur J Appl Physiol. 2012;112(4):1327-34.
- 61. Hammond MD, Bauer KA, Sharp JT, Rocha RD. Respiratory muscle strength in congestive heart failure. Chest. 1990;98(5):1091-4.
- 62. Witt C, Borges AC, Haake H, Reindl I, Kleber FX, Baumann G. Respiratory muscle weakness and normal ventilatory drive in dilative cardiomyopathy. Eur Heart J. 1997;18:1322-8.
- 63. Walsh JT, Andrews R, Johnson P, Phillips L, Cowley AJ, Kinnear WJ. Inspiratory muscle endurance in patients with chronic heart failure. Heart. 1996;76(4):332-6.
- 64. Mancini DM, Ferraro N, Nazzaro D, Chance B, Wilson JR. Respiratory muscle deoxygenation during exercise in patients with heart failure demonstrated with near-infrared spectroscopy. J Am Coll Cardiol. 1991;18(2):492-8.
- 65. Borghi-Silva A, Carrascosa C, Oliveira CC, Barroco AC, Berton DC, Vilaça D, et al. Effects of respiratory muscle unloading on leg muscle oxygenation and blood volume during high-intensity exercise in chronic heart failure. Am J Physiol Heart Circ Physiol. 2008;294(6):H2465-72.
- 66. Olson TP, Joyner MJ, Dietz NM, Eisenach JH, Curry TB, Johnson BD. Effects of respiratory muscle work on blood flow distribution during exercise in heart failure. J Physiol. 2010;588(Pt 13):2487-501.
- 67. Bosnak-Guclu M, Arikan H, Savci S, Inal-Ince D, Tulumen E, Aytemir K, et al. Effects of inspiratory muscle training in patients with heart failure. Respir Med. 2011;105(4):1671-81.
- 68. Laoutaris ID, Dritsas A, Brown MD, Manginas A, Kallistratos MS, Sfirakis P, et al. Inspiratory muscle training in a patient with left ventricular assist device. Hellenic J Cardiol. 2006;47(4):238-41.
- 69. Jaenisch RB, Hentschke VS, Quagliotto E, Cavinato PR, Schmeing LA, Xavier LL, et al. Respiratory muscle training improves hemodynamics, autonomic function, baroreceptor sensitivity, and respiratory mechanics in rats with heart failure. J Appl Physiol. 2011;111(6):1664-70.
- 70. Borghi-Silva A, Di Thommazo L, Pantoni CB, Mendes RG, Salvini Tde F, Costa D. Non-invasive ventilation improves peripheral oxygen saturation and reduces fatigability of quadriceps in patients with COPD. Respirology. 2009;14(4):537-44.
- 71. Chiappa GR, Queiroga FJr, Meda E, Ferreira LF, Diefenthaeler F, Nunes M, et al. Heliox improves oxygen delivery and utilization during dynamic exercise in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2009;179(11):1004-10.
- 72. van't Hul A, Gosselink R, Hollander P, Postmus P, Kwakkel G. Acute effects of inspiratory pressure support during exercise in patients with COPD. Eur Respir J. 2004;23(1):34-40.
- 73. Borghi-Silva A, Mendes RG, Toledo AC, Malosá Sampaio LM, da Silva TP, Kunikushita LN, et al. Adjuncts to physical training of patients with severe COPD: oxygen or noninvasive ventilation? Respir Care. 2010;55(7):885-94.
- 74. Wong E, Selig S, Hare DL. Respiratory muscle dysfunction and training in chronic heart failure. Heart Lung Circ. 2011;20(5):289-94.
Contribuição da musculatura inspiratória na limitação ao exercício na insuficiência cardíaca: mecanismos fisiopatológicos
Datas de Publicação
-
Publicação nesta coleção
17 Jul 2012 -
Data do Fascículo
Ago 2012
Histórico
-
Recebido
28 Jul 2011 -
Aceito
28 Mar 2012 -
Revisado
24 Jan 2012






