Resumos
Nos últimos vinte anos, houve um maior reconhecimento de que a gravidez em algumas mulheres pode ser complicada por problemas emocionais, particularmente depressão, causando um impacto significativo sobre a mãe e a criança. Com a identificação de fatores de risco para a depressão pós-parto e um aumento do conhecimento sobre a vulnerabilidade biológica para os transtornos de humor no período puerperal, um número crescente de estudos tem explorado meios de prevenir a depressão pós-parto, utilizando estratégias psicossociais, psicofarmacológicas e hormonais. A maior parte das intervenções psicossociais e hormonais tem mostrado pouco efeito para a prevenção da depressão pós-parto. Apesar disso, resultados de estudos preliminares sobre a terapia interpessoal, terapia cognitivo-comportamental e sobre o uso de antidepressivos indicam que estas intervenções podem resultar em algum benefício. Dados sobre o uso de suplementos dietéticos são limitados e com resultados pouco conclusivos. A excessiva quantidade de resultados negativos na literatura atual demonstra que a depressão pós-parto ainda não pode ser facilmente prevenida.
Depressão pós-parto; Transtornos puerperais; Depressão; Antidepressivos; Adaptação psicológica; Relações mãe-filho; Saúde da mulher
In the past 20 years, there has been increasing recognition that for some women, pregnancy may be burdened with mood problems, in particular depression, that may impact both mother and child. With identification of risk factors for postpartum depression and a growing knowledge about a biologic vulnerability for mood change following delivery, research has accumulated on attempts to prevent postpartum depression using various psychosocial, psychopharmacologic, and hormonal strategies. The majority of psychosocial and hormonal strategies have shown little effect on postpartum depression. Notwithstanding, results from preliminary trials of interpersonal therapy, cognitive-behavioural therapy, and antidepressants indicate that these strategies may be of benefit. Information on prevention of postpartum depression using dietary supplements is sparse and the available evidence is inconclusive. Although a few studies show promising results, more rigorous trials are required. The abounding negative evidence in the literature indicates that postpartum depression cannot be easily prevented, yet.
Depression, postpartum; Puerperal disorders; Depression; Antidepressive agents; Adaptation, psychological; Mother-child relations; Women's health
Depressão pós-parto: sabemos os riscos, mas podemos preveni-la?
Dawn ZingaI; Shauna Dae PhillipsII,III;Leslie BornIII,IV
IDepartamento de Estudos sobre a Infância e a Juventude, Brock University, St. Catharines, Ontário, Canadá
IIClínica de Preocupação com a Saúde da Mulher, St. Joseph's Healthcare, Hamilton, Ontário, Canadá
IIIPrograma de Ciências Médicas, McMaster University, Hamilton, Ontário, Canadá
IVPrograma de Risco Materno, The Hospital for Sick Children, Toronto, Ontário, Canadá
Correspondência Correspondência Dawn Zinga Department of Child and Youth Brock University St. Catharines, Ontario, Canada L2S 3A1 Tel: (905) 688-5550, ext. 3152 Fax: (905) 641-2509 E-mail: dzinga@brocku.ca
RESUMO
Nos últimos vinte anos, houve um maior reconhecimento de que a gravidez em algumas mulheres pode ser complicada por problemas emocionais, particularmente depressão, causando um impacto significativo sobre a mãe e a criança. Com a identificação de fatores de risco para a depressão pós-parto e um aumento do conhecimento sobre a vulnerabilidade biológica para os transtornos de humor no período puerperal, um número crescente de estudos tem explorado meios de prevenir a depressão pós-parto, utilizando estratégias psicossociais, psicofarmacológicas e hormonais. A maior parte das intervenções psicossociais e hormonais tem mostrado pouco efeito para a prevenção da depressão pós-parto. Apesar disso, resultados de estudos preliminares sobre a terapia interpessoal, terapia cognitivo-comportamental e sobre o uso de antidepressivos indicam que estas intervenções podem resultar em algum benefício. Dados sobre o uso de suplementos dietéticos são limitados e com resultados pouco conclusivos. A excessiva quantidade de resultados negativos na literatura atual demonstra que a depressão pós-parto ainda não pode ser facilmente prevenida.
Descritores: Depressão pós-parto/quimioterapia; Transtornos puerperais/psicologia; Depressão/psicologia; Antidepressivos/uso terapêutico; Adaptação psicológica; Relações mãe-filho; Saúde da mulher
Introdução
Nos últimos 20 anos, tem havido um crescente reconhecimento de que, para algumas mulheres, a gravidez pode ser sobrecarregada por muitos transtornos do humor, em particular pela depressão. Esse conhecimento segue no sentido contrário ao de uma crença popular amplamente difundida de que a gravidez é um período de alegria para todas as mulheres. Os pesquisadores também reconheceram que os transtornos do humor durante a gravidez colocam as mulheres em risco de terem depressão pós-parto (DPP). Conseqüentemente, houve um deslocamento na literatura, de um foco voltado para os sintomas e tratamento da DPP para um foco no tratamento da depressão ou ansiedade durante a gravidez, a fim de evitar uma piora dos sintomas durante o período pós-parto. Nos últimos anos, houve um conjunto de estudos que objetivou a prevenção da DPP, incluindo mulheres que foram identificadas como sob risco de DPP estando eutímicas ou sintomáticas durante a gravidez.
Este artigo irá revisar a literatura atual sobre a etiologia e os fatores de risco de DPP, e as estratégias psicossociais e farmacológicas que têm sido tentadas em um esforço para prevenir o início do transtorno em mulheres em risco.
Prevalência de depressão na gravidez
Estima-se que de 25 a 35% das mulheres apresentam sintomas depressivos na gravidez e que até 20% das mulheres podem preencher os critérios para depressão.1-3 Encontrou-se que os índices de sintomas depressivos são mais altos durante o terceiro trimestre do que seis meses após o parto.4 Durante a gravidez, no entanto, os pesquisadores encontraram um pico na depressão no primeiro trimestre, uma melhoria dos sintomas durante o segundo semestre e um aumento do índice de depressão durante o terceiro trimestre.2-3,5
Evidências crescentes na literatura demonstram que os transtornos psiquiátricos durante a gravidez são subdetectados e subtratados na prática clínica. Marcus et al investigaram prospectivamente 3.472 mulheres grávidas em vários serviços obstétricos (Center for Epidemiological Studies-Depression Scale [CES-D]) quanto à depressão atual, ao uso de medicações antidepressivas, ao histórico de depressão e ao tratamento atual, incluindo medicação, psicoterapia ou aconselhamento.6 Das mulheres investigadas, 20% (n = 689) tinham escores suficientes para depressão na CES-D. Somente 13,8% (n = 95) das mulheres com escores para depressão do CES-D relataram estarem recebendo algum tipo de tratamento antidepressivo.
1. Prevalência de transtornos de humor no período pós-parto
Oito de cada 10 mulheres podem apresentar a melancolia da maternidade (postpartum blues), um transtorno transitório do humor tipicamente marcado por labilidade do humor, momentos de choro, irritabilidade e transtorno do sono, que perdura cerca de duas semanas após o parto.7 Em algumas mulheres, os sintomas depressivos não se resolvem e persistem, levando à depressão pós-parto.8
Estudos epidemiológicos identificaram uma variação da prevalência de depressão pós-parto (DPP) entre 10 e 20%.9 Aproximadamente um em cada 1.000 partos é seguido de um episódio psicótico.10
2. Relevância do humor para o bem-estar da mãe e do bebê
A depressão durante a gravidez está associada ao menor cuidado pré-natal, incluindo má nutrição e hábitos de sono irregulares. Um pequeno estudo em Michigan, EUA, com uma amostra etnicamente diversa, revelou que aproximadamente 15% das mulheres (n = 169) relataram uso de álcool durante a gravidez.11 Recentes evidências adicionais mostram que o consumo de álcool está positiva e linearmente relacionado com depressão antenatal.12 O beber compulsivo durante a gravidez também está associado ao tabagismo.11
Em uma amostra de 1.399 mulheres negras americanas de baixa renda, 117 tiveram um parto pré-termo. Entre essas mulheres, o nascimento pré-termo espontâneo ocorreu em 12,7% das que tinham sintomas depressivos e em 8% das sem sintomas depressivos, de acordo com o CES-D.13 Os resultados de Dole et al indicam que uma alta ansiedade materna está também associada ao nascimento pré-termo.14 De 1.962 mulheres, o parto pré-termo ocorreu em 231 casos. Quarenta e dois por cento das mulheres com alta ansiedade pré-natal tiveram partos pré-termo, comparadas a 29% com alta ansiedade pré-natal que tinham dado à luz a termo. Ainda que a depressão neste estudo não tenha sido um fator significativo em partos pré-termo, ela pode aumentar a propensão de partos pré-termo em mulheres negras americanas, uma população mais vulnerável a partos pré-termo espontâneos.15
A DPP tem sido vinculada a rupturas no funcionamento da díade mãe-bebê, tais como na atenção, na comunicação vocal e visual, menor freqüência de interações que envolvem tocar e sorrir, em comparação com díades que incluem mães não deprimidas.16-17 Mães deprimidas demonstraram também comportamentos mais invasivos e irritáveis em relação a seus bebês e responderam de forma menos sensível e contingente e mais negativa a seus bebês.16,18
Bebês e crianças até dois anos podem ser particularmente vulneráveis aos efeitos negativos de DPP.19 As pesquisas demonstraram que os filhos de mulheres com DPP mostram altos índices de insegurança vincular, alguns atrasos no desenvolvimento cognitivo e emocional e mais disforia.20
Apesar dos achados de que a piora do funcionamento materno associado à DPP desaparece na altura do 16º mês após o parto,16 há crescentes evidências que sugerem que pode haver implicações de longo prazo para o desenvolvimento das crianças.21 Além disso, a gravidade e a cronicidade da depressão materna predizem claramente dificuldades de desenvolvimento.19-20,22
Etiologia da depressão pós-parto
O conhecimento atual sugere que algumas mulheres possuem uma sensibilidade particular a alterações hormonais, começando no início da menarca, o que aumenta sua vulnerabilidade aos estressores psicológicos, ambientais e fisiológicos durante a menacme.7 Em mulheres suscetíveis, esses estressores desencadeiam a alteração de um estado já vulnerável para a manifestação de um transtorno do humor especificamente feminino em momentos de altas flutuações hormonais, tais como no parto.
1. A teoria da retirada hormonal
A evidência mais reforçadora de uma etiologia hormonal significativa foi demonstrada por um experimento que simulou os níveis suprafisiológicos do estradiol e da progesterona em fases avançadas da gravidez e sua subseqüente retirada (i.e., parto), em mulheres com ou sem histórico de DPP.23 Os escores na escala de depressão foram significativamente mais altos durante a fase de retirada de hormônios em mulheres com histórico prévio de DPP, ao passo que o grupo sem esse histórico demonstrou alterações mínimas nos escores de humor. Houve uma melhora subseqüente na classificação do humor no primeiro grupo com o retorno da função ovariana.
Foram demonstradas interações recíprocas entre o eixo hipotálamo-pituitária-gonadal (HPG) e o sistema serotoninérgico. Os baixos níveis dos esteróides gonadais que são típicos do puerpério podem diminuir a atividade serotoninérgica central e proporcionar uma vulnerabilidade maior ao desenvolvimento de sintomas de humor em mulheres suscetíveis. Uma linha de pensamento é que o transtorno de humor do pós-parto pode ser subvertido pelo "ajuste" dos níveis hormonais ou pela "reversão" da sensibilidade do sistema de neurotransmissores.24 Um estudo piloto sobre profilaxia, discutido mais abaixo, tentou exitosamente "amortecer" a drástica queda no estradiol após o parto.
2. Estudos genéticos
A hipótese de um componente biológico relacionado aos transtornos de humor pós-parto foi levantada a partir da análise do histórico familiar e dos estudos de gêmeos. A prevalência ao longo da vida de transtornos do humor e transtornos relacionados em familiares de primeiro grau de mulheres com transtornos de humor pós-parto é muito maior que na população geral, o que indica um possível componente genético ou familiar relacionado a esses transtornos.25
As evidências dos estudos de disforia pré-menstrual demonstraram que o sistema serotoninérgico tem uma relação estreita e recíproca com os hormônios gonadais.7 Há evidências preliminares de que ocorre uma predisposição genética à atividade alterada do sistema de transporte da serotonina em mulheres com disforia pré-menstrual grave (M Steiner, dados não publicados). Um polimorfismo do promotor ligado ao transportador de serotonina (5-HTTLPR) foi associado à depressão maior.26 Embora a relação recíproca entre o sistema serotoninérgico e os hormônios gonadais ainda não tenha sido estudada em mulheres grávidas ou no pós-parto, é plausível que a retirada súbita do estrogênio no parto possa desencadear alterações do humor em mulheres geneticamente vulneráveis.
Fatores de risco para depressão pós-parto
A literatura demonstra consistentemente que um histórico pessoal ou familiar de doença psiquiátrica pode aumentar o risco de grave transtorno emocional no pós-parto. Isso inclui histórico psiquiátrico de transtornos de humor ou ansiedade, inclusive síndrome pré-menstrual ou abuso sexual;25,27-28 e histórico familiar de transtorno psiquiátrico, inclusive alcoolismo, DPP ou psicose pós-parto.25,29 Em um estudo prospectivo controlado, Cooper e Murray encontraram que 41% dos indivíduos estudados experimentaram um episódio subseqüente de DPP após um primeiro (índice) episódio de depressão com início após o parto.30
Humor deprimido ou ansioso durante a gravidez ou sintomas de elação no início do puerpério estão associados à DPP subseqüente,1,29 da mesma forma que traços neuróticos ou vulneráveis de personalidade.29 Mulheres deprimidas que bebem ou fumam compulsivamente durante a gravidez possuem maior risco de que sua depressão continue no período pós-parto.31 O nível de ansiedade pré-natal parece estar positivamente relacionado ao nível de depressão pós-natal.32
Ainda que as depressões pré e pós-parto possam ocorrer independentemente uma da outra e existam distintos perfis psiconeuroendócrinos,33 sugere-se que muitos dos transtornos de humor pós-parto possam, na verdade, começar durante a gravidez ou que a depressão antes do parto aumente o risco de desenvolver DPP.34
Para algumas mulheres, especialmente mães primíparas, a transição para a maternidade pode ser difícil e combinada com baixa auto-estima,35 particularmente se a gravidez não tiver sido planejada.36 Mulheres socialmente isoladas da família, dos amigos ou de seus parceiros têm maior probabilidade de experimentar sintomas depressivos no período pós-parto.37 Isso pode ser especialmente verdadeiro para mulheres que imigraram recentemente e que vivenciam barreiras geográficas e lingüísticas.38 Outros eventos de vida negativos, tais como a perda de um emprego ou a morte de um familiar próximo também são preditores de DPP.29
Têm sido encontradas associações entre a presença de complicações obstétricas, tais como hemorragia pré-parto ou cesariana de emergência; ou privação do sono ao final da gravidez, no parto e no período imediatamente após o parto e um risco maior de DPP.29,39-40 Fatores relacionados ao bebê, tais como o temperamento da criança, estresse pelos cuidados com ela ou complicações neonatais têm sido também associados ao início de sintomatologia depressiva pós-parto.35
Há controvérsias sobre quão bem a identificação dos fatores de risco permite que os clínicos ou pesquisadores distingam entre aquelas mulheres que se tornarão deprimidas e as que permanecerão sadias. Ensaios clínicos para a prevenção de DPP e evidências relacionadas de grupos de pacientes controle não-tratados têm demonstrado que os instrumentos de triagem identificam as mulheres com alto risco de DPP, embora a eficácia desses instrumentos seja questionável na medida em que também deixam de identificar algumas mulheres em risco.41
Com a identificação dos fatores de risco de DPP, a década passada testemunhou uma maior quantidade de pesquisas sobre estratégias preventivas. Nas seções seguintes serão revisadas as estratégias de prevenção psicossocial, psicofarmacológica e hormonal.
Estratégias psicossociais
Vários ensaios clínicos utilizaram estratégias psicossociais como tentativa de evitar o desenvolvimento de DPP por meio do alívio ou eliminação dos fatores do risco psicossocial. Essas intervenções adotaram, principalmente, a forma de iniciativas educativas, melhorias no atendimento pré-natal e/ou no início do puerpério e intervenções com enfoque psicoterapêutico.
1. Iniciativas educativas
As iniciativas educativas operam com a premissa de que fornecer informações aos indivíduos ou famílias sobre o que esperar do período pós-parto reduzirá os níveis de ansiedade e ajudará a diminuir o impacto dos fatores de risco psicossociais. Algumas pesquisas associaram a educação pré-natal à redução de ansiedade e à percepção de benefícios pelas mulheres participantes,42 ao passo que outras pesquisas não encontraram redução de ansiedade.43 Em geral, as intervenções educativas pré-natais não demonstraram ser muito eficazes em reduzir a DPP.
Em um ensaio clínico randomizado controlado recente, mulheres australianas foram designadas para receber assistência pré-natal de rotina ou, além dessa, duas aulas pré-natais e uma aula pós-natal adicionais. Não houve diferenças entre os dois grupos quanto aos sintomas depressivos, medidos pelo Edinburgh Postnatal Depression Scale (EPDS) em seis semanas, três meses e seis meses após o parto.44 Outro estudo australiano não encontrou diferenças significativas nos escores de DPP entre mulheres randomizadas para aulas pré-natais padrão ou aulas pré-natais de "intervenção" focadas em problemas emocionais e na realidade da maternidade, bem como na preparação física, ainda que tenha sido observada uma diminuição da ansiedade no grupo de intervenção.45
Um terceiro estudo australiano utilizou um enfoque em três fases: primeiro identificou as mulheres em risco, a seguir forneceu educação e finalmente notificou os médicos sobre o status de cada mulher em risco.46 Mulheres que foram identificadas como estando em risco foram randomicamente distribuídas para receber tratamento específico ou atenção padrão. Aquelas que estavam no grupo de tratamento receberam um folheto educativo sobre DPP e números de telefone de recursos de saúde; além disso, seus provedores de saúde receberam uma carta alertando-os sobre o status de risco da mulher. Não houve diferenças significativas entre os dois grupos nos escores do EPDS à altura da 16ª semana após o parto.
No estudo "Preparando a maternidade", as mulheres identificadas como estando sob risco de ter DPP foram randomicamente distribuídas para receber a atenção padrão ou participar de seis aulas de educação pré-natal em grupo (os tópicos incluíram problemas sociais e emocionais da gravidez, depressão pós-parto, habilidades de suporte, solução de problemas).47 Não houve diferenças significativas entre os dois grupos três meses após o parto. É de se ressaltar que 55% das mulheres no grupo de intervenção não completaram as seis aulas.
Hayes et al implementaram um enfoque educativo em que mulheres com 28 a 36 semanas de gestação foram distribuídas randomicamente para receber atendimento pré-natal de rotina ou um pacote educativo que continha um folheto informativo para mulheres gestantes e seus familiares e uma fita de áudio sobre a experiência de uma mulher com DPP, como relatada a uma enfermeira obstétrica.48 Os resultados demonstraram que não havia diferenças significativas entre os grupos de mulheres com 8 a 12 e 16 a 24 semanas após o parto. Mulheres de ambos os grupos estavam significativamente mais deprimidas antes do parto do que após sua realização.
Dois estudos investigaram a questão da prevenção pré-natal e sua conexão com o período pós-parto. Tam et al tiveram seu foco dirigido a mulheres que tiveram complicações na gravidez que resultaram em hospitalização, cesariana ou complicações no parto.49 As mulheres foram recrutadas nas 48 horas após o nascimento e a seguir foram randomicamente distribuídas para receber atenção de rotina ou aconselhamento educativo, o que incluiu uma explicação completa do desfecho prejudicado, uma discussão sobre a resposta emocional da mulher e uma oportunidade de reconciliar-se com o evento e encontrar as soluções à medida das necessidades. Após seis semanas e seis meses do parto, não houve diferenças significativas quanto à morbidade psicológica, satisfação da cliente ou qualidade de vida entre os grupos.
Em um segundo ensaio clínico controlado, as mulheres identificadas como "vulneráveis" foram randomicamente distribuídas em um grupo de tratamento (cinco encontros pré-natais mensais em grupo e seis encontros pós-natais mensais) ou em um grupo de intervenção controle.50 Embora as mães que estavam em seu segundo parto não tivessem benefícios com o tratamento, as mães primíparas no grupo de tratamento demonstraram menos sintomas depressivos do que as do grupo controle. Os resultados deste último grupo sugerem que fazer uma transição entre os períodos pré e pós-natal pode melhorar a eficácia das iniciativas educativas.
2. Melhoria na atenção pré e pós-natal
Outro enfoque na luta para prevenir a DPP teve como alvo os provedores de saúde das mães. A lógica subjacente a esse enfoque é que o aumento no nível da atenção à saúde durante o período pré-natal ou logo após o parto pode, como conseqüência, reduzir o impacto dos fatores de risco psicossociais no humor pós-parto. No entanto, os ensaios clínicos com atenção materna melhorada completados até o momento demonstraram um impacto limitado na prevenção de DPP.
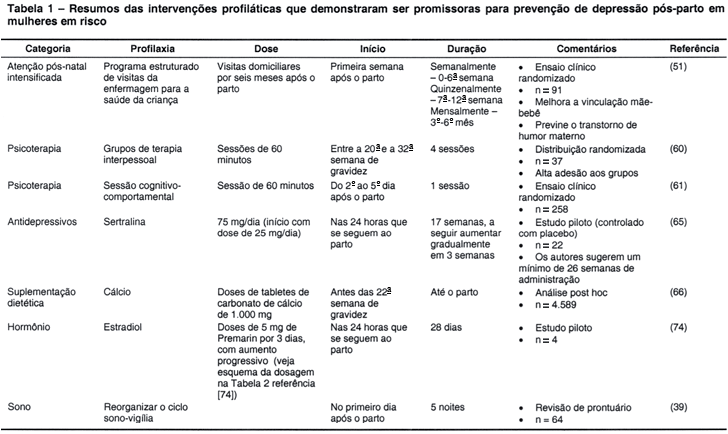
Um ensaio clínico randomizado controlado proporcionou às famílias um programa de visitas de enfermeiras para cuidar da saúde das crianças, que ocorreu semanalmente do nascimento até seis semanas após o período pós-parto, a seguir a cada duas semanas até o terceiro mês após o parto e, mensalmente, a partir daí até seis meses após o parto,51 objetivando reduzir os desfechos ruins em termos de saúde e de desenvolvimento dos filhos de mulheres que relataram fatores de risco ambientais (i.e., violência doméstica, baixa renda familiar, histórico de transtorno mental). O grupo controle recebeu atenção pós-parto padrão que incluiu uma visita domiciliar opcional e acesso ilimitado ao centro de atenção à criança por meio de consultas ambulatoriais. Os resultados demonstraram escores significativamente mais baixos no EPDS e níveis mais altos de vínculo mãe-filho no grupo de intervenção, comparado com o grupo controle.
Outro ensaio clínico randomizado controlado examinou se o acréscimo de um check-up pós-natal com o clínico geral uma semana após a alta melhoraria a saúde materna.52 Os resultados mostraram não haver diferenças entre os grupos de intervenção e os grupos-controle nas medidas dos sintomas depressivos, na satisfação com o clínico, índices de amamentação materna ou no número de problemas relatados pelas mulheres.
Vários outros estudos focaram também em alterações na atenção materna no período pós-parto inicial para melhorar os desfechos das mulheres e de seus filhos. Morrell et al examinaram o custo-benefício da implementação de suporte pós-natal em uma comunidade no Reino Unido.53 A enfermeira obstétrica da comunidade distribuiu randomicamente mulheres de mais de 17 anos, que tinham tido partos bem-sucedidos e que viviam dentro da área pesquisada, para receber visitas domiciliares de um agente de suporte pós-natal, além do atendimento domiciliar pós-natal padrão por uma enfermeira obstétrica, ou para ser parte de um grupo controle que somente recebia a atenção padrão. Embora muitas das mulheres tenham relatado satisfação com o suporte mais intenso, não houve diferenças significativas entre os grupos nos escores do EPDS ou nas medidas gerais de saúde.
Um estudo similar na área de West Midlands, do Reino Unido, examinou os resultados da modificação na atenção pós-natal comunitária e encontrou algumas diferenças estatisticamente significativas nos escores do EPDS entre o grupo controle e o grupo de tratamento.54 O grupo de tratamento recebeu atenção pós-natal individualizada para cada participante com visitas domiciliares flexíveis (a última visita domiciliar foi feita cerca de 28 dias após o parto) e uma visita de alta entre 10 a 12 semanas após o parto. O grupo controle recebeu atenção rotineira que incluiu sete visitas domiciliares por uma enfermeira obstétrica até 10 a 14 dias após o parto e uma visita de alta de 6 a 8 semanas após o parto.
Um estudo randomizado controlado examinou diretamente a prevenção de DPP por meio de um programa de atenção obstétrica contínua durante a gravidez e o pós-parto.55 Mulheres grávidas com histórico de transtorno depressivo maior foram randomizadas para receber atenção padrão (8 a 12 visitas obstétricas pré-natais, presença no trabalho e no parto, e visitas segundo a necessidade até 10 a 28 dias após o parto) ou para receber atenção contínua pela mesma enfermeira obstétrica (na medida do possível) durante a gravidez e o pós-parto. Os pesquisadores não encontraram nenhuma diferença em desfechos psiquiátricos entre os dois grupos, mas encontraram que a atenção obstétrica foi mais efetiva para engajar as mulheres no tratamento.
Outros estudos acrescentaram à atenção pós-parto padrão uma sessão de aconselhamento com o uso de perguntas/não-diretivo no período pós-natal inicial.56-58 No entanto, em uma recente revisão, Gamble et al concluíram que havia evidências insuficientes para avaliar a eficácia de sessões de perguntas na prevenção de DPP, e dois dos estudos podem ter tido efeitos prejudiciais.59
3. Intervenções com enfoque psicoterapêutico
Ao contrário dos achados majoritariamente negativos advindos de iniciativas educacionais e da melhoria da atenção às mães, dois estudos preliminares que utilizaram intervenções de enfoque psicoterapêutico específicas mostraram alguns resultados promissores nos esforços para prevenir a ocorrência de DPP.
Um estudo nos EUA encontrou que a terapia interpessoal foi eficaz para prevenir DPP em uma amostra de mulheres em risco.60 Mulheres grávidas (n = 37), identificadas entre a 20ª e a 32ª semana de gestação como tendo relatos de pelo menos um fator de risco de DPP (i.e., depressão prévia, sintomas depressivos atuais, suporte social pobre), foram designadas randomicamente para receberem quatro sessões em grupo "orientadas de acordo com a terapia interpessoal" ou atenção padrão. As mulheres no grupo de tratamento relataram escores significativamente menores no Inventário de Depressão de Beck e nenhuma desenvolveu DPP nos três primeiros meses pós-parto. Ao contrário, três das mulheres no grupo controle desenvolveram DPP e o grupo controle como um todo mostrou uma alteração significativamente menor nos escores do Inventário de Depressão de Beck, entre a 20ª e a 32ª semana de gestação e três meses após o parto.
Em um segundo estudo realizado em três clínicas obstétricas na França, mulheres grávidas com um escore no EPDS acima de 9 foram designadas randomicamente ao grupo controle ou ao de intervenção. As mulheres de ambos os grupos permaneceram na clínica de três a cinco dias e as do grupo de intervenção diferiram dos controles, pois elas receberam uma sessão cognitivo-comportamental durante a estadia. O grupo de intervenção mostrou índices de recuperação significativamente mais altos e uma significativa redução na ocorrência de depressão "provável".61 Mesmo que o tamanho da amostra tenha sido pequeno e que a intervenção não tenha evitado a DPP em todos os membros do grupo de intervenção, foi demonstrado que a intervenção precoce utilizando uma estratégia psicoterapêutica específica entre mulheres em risco pode resultar em uma redução significativa na sintomatologia depressiva.
Estratégias psicofarmacológicas
1. Antidepressivos
1) Nortriptilina
A nortriptilina, um metabólito do antidepressivo tricíclico amitriptilina, é utilizada como um agente antidepressivo no tratamento da depressão maior, distimia e depressões atípicas.
Um estudo aberto inicial com 23 mulheres com histórico de DPP mostrou que iniciar o uso de antidepressivos nas primeiras 24 horas após o parto se associou a uma marcada redução na recorrência de depressão (1/15 mulheres) comparando com um grupo que estava sendo somente monitorado (5/8 mulheres).62
No entanto, um estudo duplo-cego controlado por placebo subseqüente mostrou que o tratamento profilático com nortriptilina não reduziu os índices de DPP. Entre mulheres eutímicas durante a gravidez índice e que tinham um histórico prévio de DPP, tratadas com nortriptilina ou placebo por 20 semanas, começando nas primeiras 24 horas após o parto, 6/26 dos sujeitos que tomaram nortriptilina preventivamente e 6/25 dos sujeitos que receberam placebo sofreram recorrências entre 1 e 16 semanas após o parto. O tempo para a recorrência não diferiu entre os grupos de tratamento. Entre a 20ª e a 28ª semana, após a descontinuação, mais três sujeitos que tomavam nortriptilina e um sujeito que recebeu placebo tiveram uma recorrência da depressão.63
2) Sertralina
A sertralina é um inibidor da recaptação da serotonina que é amplamente utilizado e que tem demonstrado possuir efeitos antidepressivos e ansiolíticos, e os dados são positivos para uso em mulheres lactantes.64
Em um estudo piloto controlado por placebo, mulheres com histórico de DPP e que estavam eutímicas durante a gravidez índice receberam sertralina por um período de 20 semanas. A sertralina foi iniciada algumas horas após o parto, foi titulada durante quatro semanas para uma dose máxima de 75 mg/dia e foi descontinuada na 20ª semana, após ter sido reduzida gradualmente a partir da 17ª semana. Das mulheres que começaram a receber sertralina (n = 14), uma teve uma recorrência de DPP na 17ª semana, uma segunda mulher teve uma recorrência de depressão na 20ª semana e uma terceira ficou deprimida na 26ª semana. Ao contrário, 4/8 das que recebiam placebo sofreram recorrência de DPP nas primeiras 17 semanas do estudo.65 Baseados nos resultados, os autores recomendaram um período mínimo de 26 semanas de tratamento antidepressivo. No entanto, são necessários estudos com períodos maiores de acompanhamento.
É importante considerar que, ao utilizar antidepressivos como profilaxia contra DPP, o timing da administração de antidepressivos ainda deve ser precisado. Em mulheres sensíveis a alterações hormonais, o começo da terapia antidepressiva depois de ocorridas as alterações hormonais pode ser demasiado tarde para ter um efeito profilático.
2. Suplementação dietética
1) Cálcio
Em um estudo paralelo de um ensaio randomizado controlado de cálcio (2.000 mg de cálcio elementar tomados na forma de tabletes de carbonato de cálcio) para prevenção de pré-eclampsia, os pesquisadores encontraram que as mulheres que receberam suplementação de cálcio durante a gestação tiveram uma prevalência estatística significativamente menor de sintomas de DPP nas 12 semanas que se seguiram ao nascimento.66 No estudo principal, mulheres (n = 4.589) receberam 1.000 mg de cálcio ou tabletes de placebo junto no café e no jantar e um suplemento pré-natal diário (50 mg de cálcio, 30 mg de ferro, 400 IU de vitamina D2), começando antes de 22 semanas de gestação até o parto.67 Seis semanas após o parto, os escores médios do EPDS eram similares entre os grupos de tratamento. Na 12ª semana, os escores médios do EPDS não foram significativamente distintos entre os grupos de cálcio e placebo. No entanto, uma proporção significativamente maior de mulheres no grupo placebo (15,3%) teve escores do EPDS > 14, em comparação ao grupo tratado com cálcio (5,7%) (p = 0,014).
Embora não sejam conhecidos os mecanismos exatos por meio dos quais o cálcio dietético pode influenciar o afeto negativo, uma linha de pensamento sugere que a suplementação de cálcio possa servir direta ou indiretamente para estabilizar a regulação de cálcio intracelular em indivíduos com dietas pobres em cálcio, o que, por sua vez, ajuda a aliviar a depressão.66 Isso ainda deve ser explorado no contexto de DPP.
2) Ácidos graxos ômega-3
O óleo de peixe, rico em ácidos graxos ômega-3, tem sido utilizado como uma medicação psicotrópica para o tratamento de depressão maior, sozinho ou como adjunto da terapia antidepressiva, com resultados mistos. Até hoje, os pesquisadores têm utilizado o ácido etil-eicosapentaenóico (EPA) ou o ácido docosahexenóico (DHA), sozinhos ou combinados. Estudos preliminares revelaram que mulheres com níveis mais baixos de plasma DHA no final da gravidez e no período inicial do pós-parto podem ter mais probabilidade de experimentar sintomas depressivos pós-parto.68 Dessa forma, o aumento da ingestão dietética de DHA ao final da gravidez ou logo após o parto pode reduzir os sintomas da DPP.
Um estudo randomizado duplo-cego controlado com 200 mg/dia de DHA por quatro meses, começando na primeira semana após o parto, não mostrou diferença estatística nas medidas de depressão entre os grupos na marca do quarto mês, independentemente do status da amamentação. Os autores notaram que as mulheres, como um grupo (n = 51 DHA; n = 50 placebo), tiveram "sintomas depressivos mínimos" na linha de base (escore na linha de base do BDI ± desvio padrão: 6,5 ± 4,2 e 7,1 ± 4,7 respectivamente).69 Há sugestões na literatura que a dose utilizada pode ter sido insuficiente para obter-se um efeito antidepressivo.70
Outro recente estudo piloto aberto (n = 7), com 2.960 mg de EPA e DHA em uma proporção de 4:1, desde a 34ª e a 36ª semanas de gravidez até 12 meses após o parto, tomadas por mulheres com histórico de DPP, mostrou que 4/7 dos indivíduos tiveram uma recaída de DPP, entre o 3º e o 61º dia após o parto.71
3. Hormônios
1) Tireoidianos
Pesquisadores demonstraram que mulheres positivas para o anticorpo antitiroperoxidase na 32ª semana de gestação possuem um risco de duas a três vezes maior para o desenvolvimento de depressão no período pós-parto.72
Harris et al levantaram a hipótese de que a administração profilática de tiroxina estabilizaria a função tiroideana após o parto e, por sua vez, evitaria a depressão pós-parto.73 Em um estudo randomizado duplo-cego, 446 mulheres eutiroidianas positivas para os anticorpos antitiroperoxidase receberam 100 µg diários de tiroxina ou placebo da 6ª à 24ª semana do pós-parto. Os resultados não revelaram um beneficio clínico substancial do tratamento; a prevalência de depressão foi similar em ambos os grupos pós-parto.
2) Estrogênios
Tomando como base que o declínio súbito e pronunciado dos hormônios no parto é um desencadeante biológico de alterações do humor em mulheres vulneráveis, um estudo explorou se o amortecimento na queda do estradiol nas horas após o parto seria efetivo como uma profilaxia contra DPP. Quatro mulheres eutímicas, que tinham tido um episódio prévio de depressão maior com início logo após o parto, receberam Premarin oral nas horas do parto, começando com uma dose tentativa de 5 mg por três dias (aproximando-se dos níveis de estradiol a termo); a dose foi lentamente reduzida para os níveis de estradiol da fase folicular, com descontinuação após o 28º dia. Todas as quatro mulheres permaneceram bem durante o puerpério agudo e no primeiro ano após o parto.74
Dois estudos adicionais demonstraram que o estrogênio é um tratamento eficaz para mulheres com diagnóstico de depressão maior de moderada a grave com início no pós-parto.75-76 Ahokas et al encontraram que os sintomas de depressão em mulheres que receberam 17beta-estradiol sublingual diminuíram rapidamente à medida que suas concentrações de estradiol séricos aumentaram e se aproximaram dos níveis da fase folicular,75 achados que se vinculam à teoria da retirada hormonal antes mencionada que se acredita estar subjacente ao desenvolvimento de DPP.
3) Progestagênios
A profilaxia com progesterona contra o desenvolvimento de DPP antecedeu o uso profilático de estradiol em pelo menos uma década e, inicialmente, os resultados pareceram promissores. A administração de progesterona imediatamente após o parto foi levantada como hipótese para auxiliar o "ajuste" das mulheres ao rápido declínio na progesterona após o parto. Noventa e quatro mulheres com um histórico de DPP receberam 100 mg de progesterona intramuscular imediatamente após o parto, durante sete dias, seguidas por aplicações de supositórios de 400 mg de progesterona por dois meses ou até o início da menstruação. A DPP foi recorrente em nove mulheres (cerca de 10%), três das quais não receberam a dose de intervenção recomendada. Dalton contrapôs esses resultados contra uma série anterior de casos em que 151/221 (68%) de mulheres não-tratadas tiveram uma recorrência de DPP.77
No entanto, um estudo randomizado controlado por placebo subseqüente encontrou que uma única dose de enantato de noretisterona de depósito, uma progestogena sintética, administrada nas primeiras 48 horas após o parto, estava associada a um risco aumentado de desenvolver DPP. Além disso, significativamente mais mulheres no grupo de intervenção queixaram-se de sangramento vaginal.78
Sono
As mulheres experimentam drásticas alterações no seu padrão e qualidade de sono a partir do final da gravidez, o que se estende bastante no período pós-parto, incluindo freqüente despertar, menos horas de sono total e latência de sono REM mais curta.79 Um recente estudo observacional prospectivo mostrou que mulheres com grave distúrbio no sono, i.e., menos de seis horas de sono total por noite, no último mês da gravidez, tiveram partos mais demorados e tiveram maior probabilidade de terem partos por cesárea.80
Crescentes evidências destacam uma associação entre a perda do sono e humor negativo em mulheres no pós-parto.81 Mulheres com trabalho de parto noturno têm demonstrado ser mais suscetíveis a humor negativo nos primeiros dias do pós-parto, conhecido como "melancolia da maternidade",82 e a psicose pós-parto.83 Foi estabelecida uma relação significativa entre auto-avaliações de fadiga e auto-avaliações de sintomas depressivos nos dias que sucedem o parto.84 Grave privação do sono é quase que universalmente relatada por mulheres que se apresentam para tratamento de DPP.85
Os resultados de estudos eletroencefalográficos do sono sugerem que as mulheres em risco de desenvolverem DPP podem revelar diferenças subjacentes em sua fisiologia do sono, mesmo quando em remissão.86 Analisando o conjunto, isso aponta para uma vulnerabilidade biológica que envolve os sistema de regulação do humor e do sono.
Uma nova linha de pesquisa é a de examinar se a re-sincronização do ciclo sono-vigília, i.e., a minimização da privação do sono, na primeira semana após o parto, em mulheres identificadas como tendo alto risco de ter DPP, evitará a ocorrência ou re-ocorrência. O protocolo profilático implementa essencialmente um conjunto de diretrizes para melhorar o sono após o parto por meio de uma estadia mais longa na enfermaria da maternidade, um quarto privado e com a colocação do bebê em uma enfermaria coletiva fora do quarto da mãe para passar a noite. Os resultados de uma revisão dos prontuários médicos (n = 64) mostraram que 21% das 42 mulheres que utilizaram a intervenção desenvolveram DPP, em comparação com 39% de 22 mulheres que receberam a atenção padrão do hospital. Entre mulheres com histórico prévio de DPP, índices similares foram observados.39 Um ensaio randomizado prospectivo controlado deste protocolo está em andamento.
Resumo e recomendações
A DPP pode ser prevenida? A resposta breve é: ainda não. De conjunto, a pesquisa aponta para um forte componente biológico subjacente à sua etiologia. A DPP pode ocorrer mesmo em mulheres sem histórico psiquiátrico familiar conhecido ou qualquer um dos fatores de risco. A literatura revela que o início da depressão pode ocorrer não somente poucas semanas após o parto, mas até sete meses após este.87 Portanto, o monitoramento cuidadoso do humor no primeiro ano após o parto é crucial, especialmente em mulheres com histórico de DPP.
Algumas poucas perguntas simples durante as visitas rotineiras do atendimento primário poderiam ser eficazes para identificar mulheres em risco de ter DPP. Essas perguntas devem inquirir sobre o histórico psiquiátrico pessoal e familiar, em particular sobre transtornos de humor e alcoolismo e, sobretudo, estabelecer o estado atual de espírito e de humor das mulheres.25
A descontinuação abrupta do regime de tratamento com psicotrópicos durante a gravidez deve ser evitada se possível, a fim de impedir uma piora da saúde psicológica. Um relato de observações em um grupo de mulheres grávidas encontrou que os sintomas depressivos pioraram significativamente após a descontinuação abrupta de antidepressivos, sendo que as mulheres haviam tomado antidepressivos em um espaço de tempo tão curto como várias semanas.88
Algumas intervenções revelaram-se promissoras para a redução da ocorrência de DPP entre mulheres em risco (Tabela 1), mas nenhuma estratégia isolada evitou esta síndrome em todas essas mulheres. Esses estudos necessitam de replicação, mas atualmente todos os resultados preliminares devem ser interpretados com cautela até que novos estudos controlados estejam disponíveis.
Referências
1. Josefsson A, Berg G, Nordin C, Sydsjo G. Prevalence of depressive symptoms in late pregnancy and postpartum. Acta Obstet Gynecol Scand. 2001;80(3):251-5.
2. Kitamura T, Shima S, Sugawara M, Toda MA. Psychological and social correlates of the onset of affective disorders among pregnant women. Psychol Med. 1993;23(4):967-75.
3. Kumar R, Robson KM. A prospective study of emotional disorders in childbearing women. Br J Psychiatry. 1984;144:35-47.
4. Evans J, Heron J, Francomb H, Oke S, Golding J. Cohort study of depressed mood during pregnancy and after childbirth. BMJ. 2001;323(7307):257-60.
5. O'Hara MW, Zekoski EM, Philipps LH, Wright EJ. Controlled prospective study of postpartum mood disorders: comparison of childbearing and nonchildbearing women. J Abnorm Psychol. 1990;99(1):3-15.
6. Marcus SM, Flynn HA, Blow FC, Barry KL. Depressive symptoms among pregnant women screened in obstetrics settings. J Womens Health (Larchmt). 2003;12(4):373-80.
7. Steiner M, Dunn E, Born L. Hormones and mood: from menarche to menopause and beyond. J Affect Disord. 2003;74(1):67-83.
8. Henshaw C, Foreman D, Cox J. Postnatal blues: a risk factor for postnatal depression. J Psychosom Obstet Gynaecol. 2004;25(3-4):267-72.
9. Brockington IF. A portfolio of postpartum disorders. In: Brockington IF. Motherhood and mental health. Oxford: Oxford University Press; 1996. p. 135-99.
10. Brockington IF. Puerperal psychosis. In: Brockington IF. Motherhood and mental health. Oxford: Oxford University Press; 1996. p. 200-84.
11. Flynn HA, Marcus SM, Barry KL, Blow FC. Rates and correlates of alcohol use among pregnant women in obstetrics clinics. Alcohol Clin Exp Res. 2003;27(1):81-7.
12. Alati R, Lawlor DA, Najman JM, Williams GM, Bor W, O'Callaghan M. Is there really a 'J-shaped' curve in the association between alcohol consumption and symptoms of depression and anxiety? Findings from the Mater-University Study of pregnancy and its outcomes. Addiction. 2005;100(5):643-51.
13. Orr ST, James SA, Blackmore Prince C. Maternal prenatal depressive symptoms and spontaneous preterm births among African-American women in Baltimore, Maryland. Am J Epidemiol. 2002;156(9):797-802.
14. Dole N, Savitz DA, Hertz-Picciotto I, Siega-Riz AM, McMahon MJ, Buekens P. Maternal stress and preterm birth. Am J Epidemiol. 2003;157(1):14-24.
15. Cooper RL, Goldenberg RL, Das A, Elder N, Swain M, Norman G, et al. The preterm prediction study: maternal stress is associated with spontaneous preterm birth at less than thirty-five weeks' gestation. National Institute of Child Health and Human Development Maternal-Fetal Medicine Units Network. Am J Obstet Gynecol. 1996;175(5):1286-92.
16. Fleming AS, Ruble DN, Flett GL, Shaul D. Postpartum adjustment in first-time mothers: Relations between mood, maternal attitudes and mother-infant interactions. Dev Psychol. 1988;24(1):71-81.
17. Righetti-Veltema M, Conne-Perreard E, Bousquet A, Manzano J. Postpartum depression and mother-infant relationship at 3 months old. J Affect Disord. 2002;70(3):291-306.
18. Murray L, Kempton C, Woolgar M, Hooper R. Depressed mothers' speech to their infants and its relation to infant gender and cognitive development. J Child Psychol Psychiatry. 1993;34(7):1083-101.
19. Goodman SH, Gotlib IH. Risk for psychopathology in the children of depressed mothers: A developmental model for understanding mechanisms of transmission. Psychol Rev. 1999;106(3):458-90.
20. Cummings EM, Davies PT. Depressed parents and family functioning: Interpersonal effects and children's functioning and development. In: Joiner TE, Coyne JC, editors. The interactional nature of depression: advances in interpersonal approaches. Washington, DC: American Psychological Association; 1999. p. 299-327.
21. Murray L, Fiori-Cowley A, Hooper R, Cooper P. The impact of postnatal depression and associated adversity on early mother-infant interactions and later infant outcome. Child Dev. 1996;67(5):2512-26.
22. Chronicity of maternal depressive symptoms, maternal sensitivity, and child functioning at 36 months. NICHD Early Child Care Research Network. Dev Psychol. 1999;35(5):1297-310.
23. Bloch M, Schmidt PJ, Danaceau M, Murphy J, Nieman L, Rubinow DR. Effects of gonadal steroids in women with a history of postpartum depression. Am J Psychiatry. 2000;157(6):924-30.
24. Bloch M, Daly RC, Rubinow DR. Endocrine factors in the etiology of postpartum depression. Compr Psychiatry. 2003;44(3):234-46.
25. Steiner M. Postnatal depression: a few simple questions. Fam Pract. 2002;19(5):469-70.
26. Kendler KS, Kuhn JW, Vittum J, Prescott CA, Riley B. The interaction of stressful life events and a serotonin transporter polymorphism in the prediction of episodes of major depression: a replication. Arch Gen Psychiatry. 2005;62(5):529-35.
27. Sugawara M, Toda MA, Shima S, Mukai T, Sakakura K, Kitamura T. Premenstrual mood changes and maternal mental health in pregnancy and the postpartum period. J Clin Psychol. 1997;53(3):225-32.
28. Buist A. Childhood abuse, parenting and postpartum depression. Aust N Z J Psychiatry. 1998;32(4):479-87. 29. O'Hara MW, Swain AM. Rates and risk of postpartum depression-a meta-analysis. Int Rev Psychiatry. 1996;8(3):37-54.
30. Cooper PJ, Murray L. Course and recurrence of postnatal depression. Evidence for the specificity of the diagnostic concept. Br J Psychiatry. 1995;166(2):191-5.
31. Homish GG, Cornelius JR, Richardson GA, Day NL. Antenatal risk factors associated with postpartum comorbid alcohol use and depressive symptomatology. Alcohol Clin Exp Res. 2004;28(8):1242-8.
32. Josefsson A, Angelsioo L, Berg G, Ekstrom CM, Gunnervik C, Nordin C, et al. Obstetric, somatic, and demographic risk factors for postpartum depressive symptoms. Obstet Gynecol. 2002;99(2):223-8.
33. Hayes BA, Muller R. Prenatal depression: a randomized controlled trial in the emotional health of primiparous women. Res Theory Nurs Pract. 2004;18(2-3):165-83.
34. Yonkers KA, Ramin SM, Rush AJ, Navarrete CA, Carmody T, March D, et al. Onset and persistence of postpartum depression in an inner-city maternal health clinic system. Am J Psychiatry. 2001;158(11):1856-63.
35. Berggren-Clive K. Out of the darkness and into the light: women's experiences with depression after childbirth. Can J Commun Ment Health. 1998;17(1):103-20.
36. Beck CT. Revision of the postpartum depression predictors inventory. J Obstet Gynecol Neonatal Nurs. 2002;31(4):394-402.
37. Seguin L, Potvin L, St-Denis M, Loiselle J. Chronic stressors, social support, and depression during pregnancy. Obstet Gynecol. 1995;85(4):583-9.
38. Dennis CL, Janssen PA, Singer J. Identifying women at-risk for postpartum depression in the immediate postpartum period. Acta Psychiatry Scand. 2004;110(5):338-46.
39. Causey S, Fairman M, Nicholson D, Steiner M. Can postpartum depression be prevented? Arch Women Ment Health. 2001;3(Suppl 2):12-3.
40. Boyce PM, Todd AL. Increased risk of postnatal depression after emergency caesarean section. Med J Aust. 1992;157(3):172-4.
41. O'Hara MW, Gorman LL. Can postpartum depression be predicted? Primary Psychiatry. 2004;11(3):42-7.
42. Wheatley SL, Brugha TS. Just because I like it doesn't mean it has to work: Personal experience of an antenatal psychosocial intervention designed to prevent postnatal depression. Int J Ment Health Promotion. 1999;2(1):26-31.
43. Maymon R, Shiloh S, Maymon BB, Chen M, Bahany C. The effectiveness of childbirth preparation courses: a cognitive perspective. J Psychosom Obstet Gynaecol. 1992;13(1):21-36.
44. Stamp GE, Williams AS, Crowther CA. Evaluation of an antenatal and postnatal support to overcome postnatal depression: a randomized controlled trial. Birth. 1995;22(3):138-43.
45. Buist A, Westley D, Hill C. Antenatal prevention of postnatal depression. Arch Women Ment Health. 1999;1:167-73.
46. Webster J, Pritchard MA, Creedy D, East C. A simplified predictive index for the detection of women at risk for postnatal depression. Birth. 2003;30(2):101-8.
47. Brugha TS, Wheatley S, Taub NA, Culverwell A, Friedman T, Kirwan P, et al. Pragmatic randomized trial of antenatal intervention to prevent postnatal depression by reducing psychosocial risk factors. Psychol Med. 2002;30(6):1273-81.
48. Hayes BA, Muller R, Bradley, BS. Perinatal depression: a randomized controlled trial of an antenatal education intervention for primiparas. Birth. 2001;28(1):28-35.
49. Tam WH, Lee DT, Chui HF, Ma KC, Lee A, Chung TK. A randomised controlled trial of educational counseling on the management of women who have suffered suboptimal outcomes in pregnancy. BJOG. 2003;110(9):853-9.
50. Elliott SA, Leverton TJ, Sanjack M, Turner H, Cowmeadow P, Hopkins J, et al. Promoting mental health after childbirth : A controlled trial of postnatal depression. Br J Clin Psychol. 2000;39(Pt 3):223-41.
51. Armstrong KL, Fraser JA, Dadds MR, Morris J. A randomized, controlled trial of nurse home visiting to vulnerable families with newborns. J Pediatr Child Health. 1999;35(3):237-44.
52. Gunn J, Lumley J, Chondros P, Young D. Does an early postnatal check-up improve maternal health: results from a randomised trial in Australian general practice. Br J Obstet Gynaecol. 1998;105(9):991-7.
53. Morrell JC, Spiby H, Stewart P, Walters S, Morgan A. Costs and effectiveness of community postnatal support workers: randomised controlled trial. BMJ. 2000;321(7261):593-8.
54. MacArthur C, Winter HR, Bick DE, Knowles H, Lilford R, Henderson C, et al. Effects of redesigned community postnatal care on women's health 4 months after birth: A cluster randomised controlled trial. Lancet. 2002;359(9304):378-85.
55. Marks MN, Siddle K, Warwick C. Can we prevent postnatal depression? A randomized controlled trial to assess the effect of continuity of midwifery care on the rates of postnatal depression in high-risk women. J Matern Fetal Neonatal Med. 2003;13(2):119-27.
56. Hagan R, Evans SF, Pope S. Preventing postnatal depression in mothers of very preterm infants: a randomised controlled trial. BJOG. 2004;111(7):641-7.
57. Lavender T, Walkinshaw SA. Can midwives reduce postpartum psychological morbidity? A randomized trial. Birth. 1998;25(4):215-9.
58. Small R, Lumley J, Donohue L, Potter A, Waldenstrom U. Randomised controlled trial of midwife led debriefing to reduce maternal depression after operative childbirth. BMJ. 2000;321(7268):1043-7.
59. Gamble JA, Creedy DK, Webster J, Moyle W. A review of the literature on debriefing or non-directive counseling to prevent postpartum emotional distress. Midwifery. 2002;18(1):72-9.
60. Zlotnick C, Johnson SL, Miller IW, Pearlstein T, Howard M. Postpartum depression in women receiving public assistance: Pilot study of an interpersonal-therapy-oriented group intervention. Am J Psychiatry. 2001;158(4):638-40.
61. Chabrol H, Teissedre F, Saint-Jean M, Teisseyre N, Roge B, Mullet E. Prevention and treatment of post-partum depression: a controlled randomized study on women at risk. Psychol Med. 2002;32(6):1039-47.
62. Wisner KL, Wheeler SB. Prevention of recurrent postpartum major depression. Hosp Community Psychiatry. 1994;45(12):1191-6.
63. Wisner KL, Perel JM, Peindl KS, Hanusa BH, Findling RL, Rapport D. Prevention of recurrent postpartum depression: a randomized clinical trial. J Clin Psychiatry. 2001;62(2):82-6.
64. Stowe ZN, Hostetter AL, Owens MJ, Ritchie JC, Sternberg K, Cohen LS, et al. The pharmacokinetics of sertraline excretion into human breast milk: determinants of infant serum concentrations. J Clin Psychiatry. 2003;64(1):73-80.
65. Wisner KL, Perel JM, Peindl KS, Hanusa BH, Piontek CM, Findling RL. Prevention of postpartum depression: a pilot randomized clinical trial. Am J Psychiatry. 2004;161(7):1290-2.
66. Harrison-Hohner J, Coste S, Dorato V, Curet LB, McCarron D, Hatton D. Prenatal calcium supplementation and postpartum depression: an ancillary study to a randomized trial of calcium for prevention of preeclampsia. Arch Women Ment Health. 2001;3(4):141-6.
67. Levine RJ, Hauth JC, Curet LB, Sibai BM, Catalano PM, Morris CD, et al. Trial of calcium to prevent preeclampsia. N Eng J Med. 1997;337(2):69-76.
68. Otto SJ, de Groot RH, Hornstra G. Increased risk of postpartum depressive symptoms is associated with slower normalization after pregnancy of the functional docosahexaenoic acid status. Prostaglandins Leukot Essent Fatty Acids. 2003;69(4):237-43.
69. Llorente AM, Jensen CL, Voigt RG, Fraley JK, Berretta MC, Heird WC. Effect of maternal docosahexaenoic acid supplementation on postpartum depression and information processing. Am J Obstet Gynecol. 2003;188(5):1348-53.
70. Chiu CC, Huang SY, Su KP. Omega-3 polyunsaturated fatty acids for postpartum depression. Am J Obstet Gynecol. 2004;190(2):582-3; author reply 583.
71. Marangell LB, Martinez JM, Zboyan HA, Chong H, Puryear LJ. Omega-3 fatty acids for the prevention of postpartum depression: negative data from a preliminary, open-label pilot study. Depress Anxiety. 2004;19(1):20-3.
72. Kuijpens JL, Vader HL, Drexhage HA, Wiersinga WM, van Son MJ, Pop VJ. Thyroid peroxidase antibodies during gestation are a marker for subsequent depression postpartum. Eur J Endocrinol. 2001;145(5):579-84.
73. Harris B, Oretti R, Lazarus J, Parkes A, John R, Richards C, et al. Randomised trial of thyroxine to prevent postnatal depression in thyroid-antibody-positive women. Br J Psychiatry. 2002;180:327-30.
74. Sichel DA, Cohen LS, Robertson LM, Ruttenberg A, Rosenbaum JF. Prophylactic estrogen in recurrent postpartum affective disorder. Biol Psychiatry. 1995;38(12):814-8.
75. Ahokas A, Kaukoranta J, Wahlbeck K, Aito M. Estrogen deficiency in severe postpartum depression: successful treatment wth sublingual physiologic 17beta-estradiol: a preliminary study. J Clin Psychiatry. 2001;62(5):332-6.
76. Gregoire AJ, Kumar R, Everitt B, Henderson AF, Studd JW. Transdermal oestrogen for treatment of severe postnatal depression. Lancet. 1996;347(9006):930-3.
77. Dalton K. Progesterone prophylaxis used successfully in postnatal depression. Practitioner. 1985;229:507-8.
78. Lawrie TA, Hofmeyr GJ, De Jager M, Berk M, Paiker J, Viljoen E. A double-blind randomised placebo controlled trial of postnatal norethisterone enanthate: the effect on postnatal depression and serum hormones. Br J Obstet Gynaecol. 1998;105(10):1082-90.
79. Swain AM, O'Hara MW, Starr KR, Gorman LL. A prospective study of sleep, mood, and cognitive function in postpartum and nonpostpartum women. Obstet Gynecol. 1997;90(3):381-6.
80. Lee KA, Gay CL. Sleep in late pregnancy predicts length of labor and type of delivery. Am J Obstet Gynecol. 2004;191(6):2041-6.
81. Ross LE, Murray BJ, Steiner M. Sleep and perinatal mood disorders: a critical review. J Psychiatry Neurosci. 2005;30(4):247-56.
82. Wilkie G, Shapiro CM. Sleep deprivation and the postnatal blues. J Psychosom Res. 1992;36(4):309-16.
83. Sharma V, Mazmanian D. Sleep loss and postpartum psychosis. Bipolar Disord. 2003;5(2):98-105.
84. Gardner DL. Fatigue in postpartum women. Appl Nurs Res. 1991;4(2):57-62.
85. Fisher JR, Feekery CJ, Rowe-Murray HJ. Nature, severity and correlates of psychological distress in women admitted to a private mother-baby unit. J Paediatr Child Health. 2002;38(2):140-5.
86. Coble PA, Reynolds CF 3rd, Kupfer DJ, Houck PR, Day NL, Giles DE. Childbearing in women with and without a history of affective disorder. II. Electroencephalographic sleep. Compr Psychiatry. 1994;35(3):215-24.
87. Wisner KL, Perel JM, Peindl KS, Hanusa BH. Timing of depression recurrence in the first year after birth. J Affect Disord. 2004;78(3):249-52.
88. Einarson A, Selby P, Koren G. Abrupt discontinuation of psychotropic drugs during pregnancy: fear of teratogenic risk and impact of counseling. J Psychiatry Neurosci. 2001;26(1):44-8.
Financiamento: Nenhum
Conflito de interesses: Nenhum
- 1. Josefsson A, Berg G, Nordin C, Sydsjo G. Prevalence of depressive symptoms in late pregnancy and postpartum. Acta Obstet Gynecol Scand. 2001;80(3):251-5.
- 2. Kitamura T, Shima S, Sugawara M, Toda MA. Psychological and social correlates of the onset of affective disorders among pregnant women. Psychol Med. 1993;23(4):967-75.
- 3. Kumar R, Robson KM. A prospective study of emotional disorders in childbearing women. Br J Psychiatry. 1984;144:35-47.
- 4. Evans J, Heron J, Francomb H, Oke S, Golding J. Cohort study of depressed mood during pregnancy and after childbirth. BMJ. 2001;323(7307):257-60.
- 5. O'Hara MW, Zekoski EM, Philipps LH, Wright EJ. Controlled prospective study of postpartum mood disorders: comparison of childbearing and nonchildbearing women. J Abnorm Psychol. 1990;99(1):3-15.
- 6. Marcus SM, Flynn HA, Blow FC, Barry KL. Depressive symptoms among pregnant women screened in obstetrics settings. J Womens Health (Larchmt). 2003;12(4):373-80.
- 7. Steiner M, Dunn E, Born L. Hormones and mood: from menarche to menopause and beyond. J Affect Disord. 2003;74(1):67-83.
- 8. Henshaw C, Foreman D, Cox J. Postnatal blues: a risk factor for postnatal depression. J Psychosom Obstet Gynaecol. 2004;25(3-4):267-72.
- 9. Brockington IF. A portfolio of postpartum disorders. In: Brockington IF. Motherhood and mental health. Oxford: Oxford University Press; 1996. p. 135-99.
- 10. Brockington IF. Puerperal psychosis. In: Brockington IF. Motherhood and mental health. Oxford: Oxford University Press; 1996. p. 200-84.
- 11. Flynn HA, Marcus SM, Barry KL, Blow FC. Rates and correlates of alcohol use among pregnant women in obstetrics clinics. Alcohol Clin Exp Res. 2003;27(1):81-7.
- 12. Alati R, Lawlor DA, Najman JM, Williams GM, Bor W, O'Callaghan M. Is there really a 'J-shaped' curve in the association between alcohol consumption and symptoms of depression and anxiety? Findings from the Mater-University Study of pregnancy and its outcomes. Addiction. 2005;100(5):643-51.
- 13. Orr ST, James SA, Blackmore Prince C. Maternal prenatal depressive symptoms and spontaneous preterm births among African-American women in Baltimore, Maryland. Am J Epidemiol. 2002;156(9):797-802.
- 14. Dole N, Savitz DA, Hertz-Picciotto I, Siega-Riz AM, McMahon MJ, Buekens P. Maternal stress and preterm birth. Am J Epidemiol. 2003;157(1):14-24.
- 15. Cooper RL, Goldenberg RL, Das A, Elder N, Swain M, Norman G, et al. The preterm prediction study: maternal stress is associated with spontaneous preterm birth at less than thirty-five weeks' gestation. National Institute of Child Health and Human Development Maternal-Fetal Medicine Units Network. Am J Obstet Gynecol. 1996;175(5):1286-92.
- 16. Fleming AS, Ruble DN, Flett GL, Shaul D. Postpartum adjustment in first-time mothers: Relations between mood, maternal attitudes and mother-infant interactions. Dev Psychol. 1988;24(1):71-81.
- 17. Righetti-Veltema M, Conne-Perreard E, Bousquet A, Manzano J. Postpartum depression and mother-infant relationship at 3 months old. J Affect Disord. 2002;70(3):291-306.
- 18. Murray L, Kempton C, Woolgar M, Hooper R. Depressed mothers' speech to their infants and its relation to infant gender and cognitive development. J Child Psychol Psychiatry. 1993;34(7):1083-101.
- 19. Goodman SH, Gotlib IH. Risk for psychopathology in the children of depressed mothers: A developmental model for understanding mechanisms of transmission. Psychol Rev. 1999;106(3):458-90.
- 20. Cummings EM, Davies PT. Depressed parents and family functioning: Interpersonal effects and children's functioning and development. In: Joiner TE, Coyne JC, editors. The interactional nature of depression: advances in interpersonal approaches. Washington, DC: American Psychological Association; 1999. p. 299-327.
- 21. Murray L, Fiori-Cowley A, Hooper R, Cooper P. The impact of postnatal depression and associated adversity on early mother-infant interactions and later infant outcome. Child Dev. 1996;67(5):2512-26.
- 22. Chronicity of maternal depressive symptoms, maternal sensitivity, and child functioning at 36 months. NICHD Early Child Care Research Network. Dev Psychol. 1999;35(5):1297-310.
- 23. Bloch M, Schmidt PJ, Danaceau M, Murphy J, Nieman L, Rubinow DR. Effects of gonadal steroids in women with a history of postpartum depression. Am J Psychiatry. 2000;157(6):924-30.
- 24. Bloch M, Daly RC, Rubinow DR. Endocrine factors in the etiology of postpartum depression. Compr Psychiatry. 2003;44(3):234-46.
- 25. Steiner M. Postnatal depression: a few simple questions. Fam Pract. 2002;19(5):469-70.
- 26. Kendler KS, Kuhn JW, Vittum J, Prescott CA, Riley B. The interaction of stressful life events and a serotonin transporter polymorphism in the prediction of episodes of major depression: a replication. Arch Gen Psychiatry. 2005;62(5):529-35.
- 27. Sugawara M, Toda MA, Shima S, Mukai T, Sakakura K, Kitamura T. Premenstrual mood changes and maternal mental health in pregnancy and the postpartum period. J Clin Psychol. 1997;53(3):225-32.
- 28. Buist A. Childhood abuse, parenting and postpartum depression. Aust N Z J Psychiatry. 1998;32(4):479-87.
- 29. O'Hara MW, Swain AM. Rates and risk of postpartum depression-a meta-analysis. Int Rev Psychiatry. 1996;8(3):37-54.
- 30. Cooper PJ, Murray L. Course and recurrence of postnatal depression. Evidence for the specificity of the diagnostic concept. Br J Psychiatry. 1995;166(2):191-5.
- 31. Homish GG, Cornelius JR, Richardson GA, Day NL. Antenatal risk factors associated with postpartum comorbid alcohol use and depressive symptomatology. Alcohol Clin Exp Res. 2004;28(8):1242-8.
- 32. Josefsson A, Angelsioo L, Berg G, Ekstrom CM, Gunnervik C, Nordin C, et al. Obstetric, somatic, and demographic risk factors for postpartum depressive symptoms. Obstet Gynecol. 2002;99(2):223-8.
- 33. Hayes BA, Muller R. Prenatal depression: a randomized controlled trial in the emotional health of primiparous women. Res Theory Nurs Pract. 2004;18(2-3):165-83.
- 34. Yonkers KA, Ramin SM, Rush AJ, Navarrete CA, Carmody T, March D, et al. Onset and persistence of postpartum depression in an inner-city maternal health clinic system. Am J Psychiatry. 2001;158(11):1856-63.
- 35. Berggren-Clive K. Out of the darkness and into the light: women's experiences with depression after childbirth. Can J Commun Ment Health. 1998;17(1):103-20.
- 36. Beck CT. Revision of the postpartum depression predictors inventory. J Obstet Gynecol Neonatal Nurs. 2002;31(4):394-402.
- 37. Seguin L, Potvin L, St-Denis M, Loiselle J. Chronic stressors, social support, and depression during pregnancy. Obstet Gynecol. 1995;85(4):583-9.
- 38. Dennis CL, Janssen PA, Singer J. Identifying women at-risk for postpartum depression in the immediate postpartum period. Acta Psychiatry Scand. 2004;110(5):338-46.
- 39. Causey S, Fairman M, Nicholson D, Steiner M. Can postpartum depression be prevented? Arch Women Ment Health. 2001;3(Suppl 2):12-3.
- 40. Boyce PM, Todd AL. Increased risk of postnatal depression after emergency caesarean section. Med J Aust. 1992;157(3):172-4.
- 41. O'Hara MW, Gorman LL. Can postpartum depression be predicted? Primary Psychiatry. 2004;11(3):42-7.
- 42. Wheatley SL, Brugha TS. Just because I like it doesn't mean it has to work: Personal experience of an antenatal psychosocial intervention designed to prevent postnatal depression. Int J Ment Health Promotion. 1999;2(1):26-31.
- 43. Maymon R, Shiloh S, Maymon BB, Chen M, Bahany C. The effectiveness of childbirth preparation courses: a cognitive perspective. J Psychosom Obstet Gynaecol. 1992;13(1):21-36.
- 44. Stamp GE, Williams AS, Crowther CA. Evaluation of an antenatal and postnatal support to overcome postnatal depression: a randomized controlled trial. Birth. 1995;22(3):138-43.
- 45. Buist A, Westley D, Hill C. Antenatal prevention of postnatal depression. Arch Women Ment Health. 1999;1:167-73.
- 46. Webster J, Pritchard MA, Creedy D, East C. A simplified predictive index for the detection of women at risk for postnatal depression. Birth. 2003;30(2):101-8.
- 47. Brugha TS, Wheatley S, Taub NA, Culverwell A, Friedman T, Kirwan P, et al. Pragmatic randomized trial of antenatal intervention to prevent postnatal depression by reducing psychosocial risk factors. Psychol Med. 2002;30(6):1273-81.
- 48. Hayes BA, Muller R, Bradley, BS. Perinatal depression: a randomized controlled trial of an antenatal education intervention for primiparas. Birth. 2001;28(1):28-35.
- 49. Tam WH, Lee DT, Chui HF, Ma KC, Lee A, Chung TK. A randomised controlled trial of educational counseling on the management of women who have suffered suboptimal outcomes in pregnancy. BJOG. 2003;110(9):853-9.
- 50. Elliott SA, Leverton TJ, Sanjack M, Turner H, Cowmeadow P, Hopkins J, et al. Promoting mental health after childbirth : A controlled trial of postnatal depression. Br J Clin Psychol. 2000;39(Pt 3):223-41.
- 51. Armstrong KL, Fraser JA, Dadds MR, Morris J. A randomized, controlled trial of nurse home visiting to vulnerable families with newborns. J Pediatr Child Health. 1999;35(3):237-44.
- 52. Gunn J, Lumley J, Chondros P, Young D. Does an early postnatal check-up improve maternal health: results from a randomised trial in Australian general practice. Br J Obstet Gynaecol. 1998;105(9):991-7.
- 53. Morrell JC, Spiby H, Stewart P, Walters S, Morgan A. Costs and effectiveness of community postnatal support workers: randomised controlled trial. BMJ. 2000;321(7261):593-8.
- 54. MacArthur C, Winter HR, Bick DE, Knowles H, Lilford R, Henderson C, et al. Effects of redesigned community postnatal care on women's health 4 months after birth: A cluster randomised controlled trial. Lancet. 2002;359(9304):378-85.
- 55. Marks MN, Siddle K, Warwick C. Can we prevent postnatal depression? A randomized controlled trial to assess the effect of continuity of midwifery care on the rates of postnatal depression in high-risk women. J Matern Fetal Neonatal Med. 2003;13(2):119-27.
- 56. Hagan R, Evans SF, Pope S. Preventing postnatal depression in mothers of very preterm infants: a randomised controlled trial. BJOG. 2004;111(7):641-7.
- 57. Lavender T, Walkinshaw SA. Can midwives reduce postpartum psychological morbidity? A randomized trial. Birth. 1998;25(4):215-9.
- 58. Small R, Lumley J, Donohue L, Potter A, Waldenstrom U. Randomised controlled trial of midwife led debriefing to reduce maternal depression after operative childbirth. BMJ. 2000;321(7268):1043-7.
- 59. Gamble JA, Creedy DK, Webster J, Moyle W. A review of the literature on debriefing or non-directive counseling to prevent postpartum emotional distress. Midwifery. 2002;18(1):72-9.
- 60. Zlotnick C, Johnson SL, Miller IW, Pearlstein T, Howard M. Postpartum depression in women receiving public assistance: Pilot study of an interpersonal-therapy-oriented group intervention. Am J Psychiatry. 2001;158(4):638-40.
- 61. Chabrol H, Teissedre F, Saint-Jean M, Teisseyre N, Roge B, Mullet E. Prevention and treatment of post-partum depression: a controlled randomized study on women at risk. Psychol Med. 2002;32(6):1039-47.
- 62. Wisner KL, Wheeler SB. Prevention of recurrent postpartum major depression. Hosp Community Psychiatry. 1994;45(12):1191-6.
- 63. Wisner KL, Perel JM, Peindl KS, Hanusa BH, Findling RL, Rapport D. Prevention of recurrent postpartum depression: a randomized clinical trial. J Clin Psychiatry. 2001;62(2):82-6.
- 64. Stowe ZN, Hostetter AL, Owens MJ, Ritchie JC, Sternberg K, Cohen LS, et al. The pharmacokinetics of sertraline excretion into human breast milk: determinants of infant serum concentrations. J Clin Psychiatry. 2003;64(1):73-80.
- 65. Wisner KL, Perel JM, Peindl KS, Hanusa BH, Piontek CM, Findling RL. Prevention of postpartum depression: a pilot randomized clinical trial. Am J Psychiatry. 2004;161(7):1290-2.
- 66. Harrison-Hohner J, Coste S, Dorato V, Curet LB, McCarron D, Hatton D. Prenatal calcium supplementation and postpartum depression: an ancillary study to a randomized trial of calcium for prevention of preeclampsia. Arch Women Ment Health. 2001;3(4):141-6.
- 67. Levine RJ, Hauth JC, Curet LB, Sibai BM, Catalano PM, Morris CD, et al. Trial of calcium to prevent preeclampsia. N Eng J Med. 1997;337(2):69-76.
- 68. Otto SJ, de Groot RH, Hornstra G. Increased risk of postpartum depressive symptoms is associated with slower normalization after pregnancy of the functional docosahexaenoic acid status. Prostaglandins Leukot Essent Fatty Acids. 2003;69(4):237-43.
- 69. Llorente AM, Jensen CL, Voigt RG, Fraley JK, Berretta MC, Heird WC. Effect of maternal docosahexaenoic acid supplementation on postpartum depression and information processing. Am J Obstet Gynecol. 2003;188(5):1348-53.
- 70. Chiu CC, Huang SY, Su KP. Omega-3 polyunsaturated fatty acids for postpartum depression. Am J Obstet Gynecol. 2004;190(2):582-3; author reply 583.
- 71. Marangell LB, Martinez JM, Zboyan HA, Chong H, Puryear LJ. Omega-3 fatty acids for the prevention of postpartum depression: negative data from a preliminary, open-label pilot study. Depress Anxiety. 2004;19(1):20-3.
- 72. Kuijpens JL, Vader HL, Drexhage HA, Wiersinga WM, van Son MJ, Pop VJ. Thyroid peroxidase antibodies during gestation are a marker for subsequent depression postpartum. Eur J Endocrinol. 2001;145(5):579-84.
- 73. Harris B, Oretti R, Lazarus J, Parkes A, John R, Richards C, et al. Randomised trial of thyroxine to prevent postnatal depression in thyroid-antibody-positive women. Br J Psychiatry. 2002;180:327-30.
- 74. Sichel DA, Cohen LS, Robertson LM, Ruttenberg A, Rosenbaum JF. Prophylactic estrogen in recurrent postpartum affective disorder. Biol Psychiatry. 1995;38(12):814-8.
- 75. Ahokas A, Kaukoranta J, Wahlbeck K, Aito M. Estrogen deficiency in severe postpartum depression: successful treatment wth sublingual physiologic 17beta-estradiol: a preliminary study. J Clin Psychiatry. 2001;62(5):332-6.
- 76. Gregoire AJ, Kumar R, Everitt B, Henderson AF, Studd JW. Transdermal oestrogen for treatment of severe postnatal depression. Lancet. 1996;347(9006):930-3.
- 77. Dalton K. Progesterone prophylaxis used successfully in postnatal depression. Practitioner. 1985;229:507-8.
- 78. Lawrie TA, Hofmeyr GJ, De Jager M, Berk M, Paiker J, Viljoen E. A double-blind randomised placebo controlled trial of postnatal norethisterone enanthate: the effect on postnatal depression and serum hormones. Br J Obstet Gynaecol. 1998;105(10):1082-90.
- 79. Swain AM, O'Hara MW, Starr KR, Gorman LL. A prospective study of sleep, mood, and cognitive function in postpartum and nonpostpartum women. Obstet Gynecol. 1997;90(3):381-6.
- 80. Lee KA, Gay CL. Sleep in late pregnancy predicts length of labor and type of delivery. Am J Obstet Gynecol. 2004;191(6):2041-6.
- 81. Ross LE, Murray BJ, Steiner M. Sleep and perinatal mood disorders: a critical review. J Psychiatry Neurosci. 2005;30(4):247-56.
- 82. Wilkie G, Shapiro CM. Sleep deprivation and the postnatal blues. J Psychosom Res. 1992;36(4):309-16.
- 83. Sharma V, Mazmanian D. Sleep loss and postpartum psychosis. Bipolar Disord. 2003;5(2):98-105.
- 84. Gardner DL. Fatigue in postpartum women. Appl Nurs Res. 1991;4(2):57-62.
- 85. Fisher JR, Feekery CJ, Rowe-Murray HJ. Nature, severity and correlates of psychological distress in women admitted to a private mother-baby unit. J Paediatr Child Health. 2002;38(2):140-5.
- 86. Coble PA, Reynolds CF 3rd, Kupfer DJ, Houck PR, Day NL, Giles DE. Childbearing in women with and without a history of affective disorder. II. Electroencephalographic sleep. Compr Psychiatry. 1994;35(3):215-24.
- 87. Wisner KL, Perel JM, Peindl KS, Hanusa BH. Timing of depression recurrence in the first year after birth. J Affect Disord. 2004;78(3):249-52.
- 88. Einarson A, Selby P, Koren G. Abrupt discontinuation of psychotropic drugs during pregnancy: fear of teratogenic risk and impact of counseling. J Psychiatry Neurosci. 2001;26(1):44-8.
Datas de Publicação
-
Publicação nesta coleção
09 Dez 2005 -
Data do Fascículo
Out 2005