Resumo:
Numa pesquisa em abatedouros a procura de lesões em bovinos, realizada de janeiro de 2011 a julho de 2014, 544 foram encontradas, das quais 65 eram neoplasmas. Quarenta e dois porcento desses tumores eram de origem mesenquimal; 37% eram epiteliais; 14,5% eram derivados da crista neural; 5% eram tumores do cordão sexual; e 1,5 eram tumores originários do sistema nervoso periférico. O tumor mais frequentemente encontrado foi o linfoma (28% de todos os tumores), a maioria dos casos como parte do complexo leucose bovina enzoótica. O carcinoma de células escamosas foi o segundo tumor mais frequente (15% de todos os tumores). É chamada a atenção para a frequência desses tumores e para a sua importância no diagnóstico diferencial no abatedouro frigorífico entre eles e outras lesões importantes, incluindo as lesões granulomatosas da tuberculose. Houve uma ocorrência significativa do feocromocitoma adrenal (13% de todos os tumores). Papilomatose representou apenas 3% de todos os tumores. Como papilomas são comuns em bovinos, seu baixo número nesse estudo pode ser explicado pelo fato de que eles não são usualmente diagnosticados no exame post mortem (quando o couro já foi retirado da carcaça), mas sim no exame ante mortem, como ocorreu na maioria dos casos deste estudo. Tumores encontrados com menor frequência (cada um perfazendo entre 1.5 e 3% de todos os tumores) incluíram adenocarcinoma apócrino misto da cauda, adenocarcinoma mamário, adenocarcinoma uterino, carcinoma de células renais, fibroma interdigital, hemangiossarcoma, leiomioma uterino, lipoma, lipossarcoma, mesotelioma, neurofibroma, tumor de células da granulosa, tumor estromal gastrointestinal, tumores hepáticos, tumores melanocíticos, e tumores pulmonares primários. Pretende-se que os resultados dessa pesquisa possam ajudar na identificação das lesões na inspeção oficial em matadouros frigoríficos.
Termos de Indexação:
Doenças de bovinos; neoplasia; levantamento em abatedouro
Abstract:
In a survey for lesions in cattle in abattoirs from January 2011 to July 2014, 544 lesions were found, of which 65 were neoplasms. Forty two percent of those were of mesenchymal origin; 37% were epithelial; 14,5% were neural crest derivatives; 5% were sex chord derived tumors and 1.5 was from the peripheral nervous system. The most common tumor found was lymphoma (28% of all tumors), most of them as part of the enzootic leukosis complex. Squamous cell carcinoma was the second most frequent tumor (15% of all tumors). Consideration is made on the frequency of these tumors and the importance of the differential diagnosis at gross examination at the slaughterhouse among them and other important lesions, including tuberculous granulomatous lesions. There was a significance occurrence (13% of all tumors) of the adrenal tumor, pheocromocytoma. Papillomatosis represented only 3% of all tumors; as those are common benign tumors in cattle; their low numbers in this review could be explained by the fact that these are not tumors usually detected in the postmortem examination (after the hide was stripped from the carcass) which was mostly the case of this study, but rather by antemortem inspection. Less common tumors found (each accounting for 1.5 to 3% of all tumors) included granulosa cell tumor, gastrointestinal stromal tumor, hemangiosarcoma, hepatic tumors, interdigital fibroma, lipoma, liposarcoma, mammary adenocarcinoma, melanocytic tumors, mesothelioma, mixed apocrine adenocarcinoma of the tail, neurofibroma, renal cell carcinoma, primary pulmonary tumors, uterine adenocarcinoma, and uterine leiomyoma. It is intended that the results of this survey would be helpful in the identification of lesions at in the official meat inspection at the slaughterhouses.
Index Terms:
Diseases of cattle; neoplasia; slaughterhouse survey
Introdução
Os abatedouros frigoríficos são importantes fontes de detecção de doenças em animais de produção e através de estudos retrospectivos e prospectivos nesses locais, patologistas contribuem para o conhecimento de uma determinada doença ou de doenças de todo um sistema orgânico (Maxie & Miller 2016Maxie M.G. & Miller M.A. 2016. Introduction to the diagnostic process, p.1-15. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.). Dentre as lesões detectadas no exame post mortem e, eventualmente, no ante mortem, estão os neoplasmas. Segundo o Regulamento Industrial de Inspeção dos Produtos de Origem Animal (Ministério da Agricultura 1980Ministério da Agricultura. 1980. Regulamento da Inspeção Industrial e Sanitária de Produtos de Origem Animal (R.I.I.S.P.O.A). Aprovado pelo decreto no. 30690 de 20.03.52, alterado pelo decreto nº 1255, de 25.06.52. Brasília. 66p.), as carcaças, partes delas, ou órgãos afetados por tumores malignos devem ser condenados, independente da ocorrência de metástases. Uma dificuldade enfrentada pelos inspetores oficiais em estabelecimentos de abate é a falta de segurança em diagnosticar os diferentes neoplasmas para determinar o destino mais adequado das carcaças e vísceras. Consequências disso são as perdas econômicas geradas pela condenação de órgãos e carcaças que não precisariam ser totalmente condenados, além da denominação incorreta de lesões, que levam ao armazenamento de dados imprecisos e sem uniformidade entre os estabelecimentos de abate, comprometendo os dados de prevalência das doenças. O objetivo desse trabalho é proporcionar uma descrição macro e microscópica detalhada, com ilustrações dos principais neoplasmas de bovinos observados durante o abate em frigoríficos do sul do Brasil. A partir disso, espera-se auxiliar os médicos veterinários patologistas e os inspetores de frigoríficos a diagnosticarem corretamente as lesões e estabelecerem o destino mais apropriado para as carcaças e vísceras.
Material e Métodos
De janeiro de 2011 a julho de 2014, 544 amostras de lesões de bovinos destinados ao abate foram avaliadas no Laboratório de Patologia Veterinária da Universidade Federal de Santa Maria. Essas amostras eram oriundas de visitas realizadas por um dos autores (BT) aos abatedouros ou enviadas pelo inspetor responsável de cada frigorífico. Das 544 amostras, 12% eram neoplasmas. Os abatedouros visitados localizavam-se em diferentes regiões do Rio Grande do Sul. Todos os neoplasmas foram fotografados e fragmentos de tecidos foram coletados, fixados em formol a 10%, e processados rotineiramente para exame histopatológico. Em casos onde houve dúvida quanto ao diagnóstico histológico do tumor na coloração rotineira de hematoxilina e eosina, recorreu-se ao exame por imuno-histoquímica.
Resultados e Discussão
Foram encontrados 65 neoplasmas (Quadro 1), 42% dos quais eram de origem mesenquimal; 37% eram epiteliais; 14,5% eram derivados da crista neural; 5% eram tumores do cordão sexual e 1,5 eram tumores originários do sistema nervoso periférico (Quadro 2). O tumor mais frequentemente encontrado foi o linfoma (28% de todos os tumores), a maioria dos casos como parte do complexo leucose enzoótica. A classificação completa e número de tumores encontrados em cada categoria estão no Quadro 1. Os resultados referentes a cada um desses neoplasmas serão apresentados e discutidos separadamente.
Linfoma
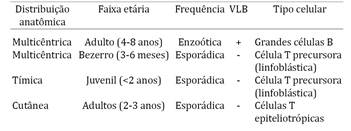
Como em outros levantamentos sobre lesões neoplásicas de bovinos abatidos em abatedouros-frigoríficos (Brandly & Migaki 1963Brandly P.J. & Migaki G.1963. Types of tumors found by federal meat inspectors in an eight year survey. Ann. N. Y. Acad. Sci. 108:1872-1879., Dukes et al. 1982Dukes T.W., Bundza A. & Corner A.H. 1982. bovine neoplasms encountered in Canadian slaughterhouses: A summary. Can. Vet. J. 23:28-30.), neste estudo, o linfoma foi também o neoplasma mais frequentemente encontrado, perfazendo 28% dos tumores diagnosticados. O linfoma é uma enfermidade neoplásica de linfócitos e tem quatro tipos de apresentação em bovinos (Barros 2007Barros C.S.L. 2007. Doenças víricas: leucose bovina, p.159-169. In: Riet- Correa F., Schild A.L., Lemos R.A.A. & Borges J.R.J. (Eds), Doenças de Ruminantes e Eqüídeos. vol. 1. 3ª ed. Pallotti, Santa Maria.): uma forma multicêntrica (vários órgãos envolvidos) de ocorrência enzoótica que afeta animais adultos de várias idades, mas predominantemente entre 4-8 anos (Valli et al. 2016Valli V.E.O., Kiupel M. & Benzle G.J.M. 2016. Hematopoietic system, p.102-268. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.); o padrão enzoótico refere-se a uma doença peculiar, a uma localidade ou região e cuja ocorrência constantemente nela se repete (Max 2007Max D.T. 2007.The Family That Couldn't Sleep: A Medical Mystery, p.167. Random House, New York.); a razão desse padrão enzoótico é que a forma multicêntrica do adulto tem natureza infeciosa, produzida por um retrovírus, o vírus da leucemia bovina (VLB). Essa forma é, por isso, conhecida como leucose bovina enzoótica (LBE). Nas outras três formas, casos individuais raros da doença ocorrem aleatoriamente e sua ocorrência não é associada à etiologia viral. O termo usado para definir esse padrão epidemiológico de doença é "esporádico" (Valli et al 2016Valli V.E.O., Kiupel M. & Benzle G.J.M. 2016. Hematopoietic system, p.102-268. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.). As três formas esporádicas são: multicêntrica do bezerro, que afeta bezerros de 3-6 meses de idade; forma tímica juvenil, que ocorre mais comumente em bovinos de 1-2 anos de idade e, a menos comum, a forma cutânea, que ocorre em bovinos de 2-3 anos de idade. Linfomas multicêntricos da LBE são constituídos por grandes células B, e os neoplasmas de ocorrência esporádica são constituídos por células T. Os principais aspectos dessas quatro formas estão resumidos no Quadro 3.
Leucose bovina. Formas de apresentação em relação ao(s) órgão(s) afetado(s), idade de aparecimento dos tumores, frequência de ocorrência, presença (+) ou ausência (-) da infecção pelo vírus da leucemia bovina (VLB) e tipo de linfócito neoplásico
Dezessete dos 18 casos de linfoma relatados neste estudo eram em animais adultos e os tumores tinham distribuição multicêntrica. Os sítios afetados incluíam linfonodos, coração, abomaso, omaso, serosa intestinal, rim, músculo estriado (diafragma), espaço epidural de medula espinhal e mesentério. A idade e a distribuição das lesões sugerem que se tratasse de casos da forma multicêntrica do adulto (LBE). Um caso envolvia o timo; não se sabe a idade do animal deste bovino, mas a lesão sugere que se trate da forma tímica juvenil. Para o controle da doença é importante a determinação de sua forma clínico-patológica, pois no caso da LBE o proprietário deve ser alertado para poder tomar as medidas adequadas para o controle.
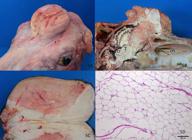
Os achados macroscópicos do linfoma nos bovinos deste estudo eram bastante característicos, permitindo o diagnóstico. O neoplasma é macio, tem superfície de corte branco-amarelada homogênea, semelhante à gordura. Em casos de linfonodos, frequentemente a arquitetura do órgão ficava obliterada e não se observava distinção entre a cortical e a medular (Fig.1A), mas apresentações de nódulos brancos e macios no parênquima dos órgãos afetados podem também ocorrer, embora linfomas foliculares em bovinos sejam extremamente raros. Por vezes áreas vermelhas de hemorragias ou amolecidas e esverdeadas (necrose) eram observadas no parênquima tumoral. Histologicamente, aglomerados de linfócitos neoplásicos apresentavam-se distribuídos em diversos órgãos (Fig.1D). Já foi demonstrado que as células que compõem os tumores na LBE são grandes linfócitos B neoplásicos (Valli et al. 2016Valli V.E.O., Kiupel M. & Benzle G.J.M. 2016. Hematopoietic system, p.102-268. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.). A proliferação dessas células produz massas tumorais sólidas (linfomas = linfossarcomas) nas mais diversas localizações anatômicas (distribuição multicêntrica) em cerca de 1-5% dos bovinos infectados. A principal forma de disseminação do vírus da LBE é associada às práticas de manejo adotadas na propriedade. Ocorre também transmissão mecânica por tabanídeos nos meses com temperatura elevada; a infecção congênita pode ocorrer em 4-8% dos terneiros nascidos de vacas soropositivas em rebanhos naturalmente infectados (Valli et al. 2016Valli V.E.O., Kiupel M. & Benzle G.J.M. 2016. Hematopoietic system, p.102-268. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.).
Linfoma. (A) Linfonodo afetado aumentado de volume e com arquitetura substituída, por uma massa branca-amarelada, com áreas vermelhas de hemorragia; não há distinção entre as camadas cortical e medular. (B) Abomaso com dobras da mucosa espessadas e brancacentas devido à infiltração tumoral. Observam-se também úlceras lineares multifocais. (C) As paredes do átrio e ventrículo direitos mostram áreas brancacentas que correspondem à infiltração tumoral. (D) Histopatologia do miocárdio. As miofibras cardíacas estão parcialmente substituídas por um manto de células redondas, pequenas e monomórficas que possuem limites citoplasmáticos distintos, citoplasma escasso e núcleo redondo e fortemente basofílico. HE, obj.20x.
Linfonodos são os órgãos mais afetados e os ilíacos internos e os mesentéricos os mais envolvidos na maioria dos bovinos; esses linfonodos tendem a ser firmes, com superfície de corte branco-amarelada homogênea, podendo ser discretamente lobulados, sem distinção entre a medular e a cortical (Barros 2007Barros C.S.L. 2007. Doenças víricas: leucose bovina, p.159-169. In: Riet- Correa F., Schild A.L., Lemos R.A.A. & Borges J.R.J. (Eds), Doenças de Ruminantes e Eqüídeos. vol. 1. 3ª ed. Pallotti, Santa Maria.). Outros órgãos envolvidos na forma multicêntrica do adulto incluem coração, abomaso, rim, intestinos, tecidos retrobulbares do olho, útero, tecidos epidurais da medula espinhal e, raramente, o cérebro (Fighera & Barros 2004Fighera R.A. & Barros C.S.L. 2004. Linfossarcoma intracerebral em bovino. Ciência Rural 34:943-945..). Neste estudo, além dos linfonodos, coração (Fig.1C) e abomaso (Fig.1B), foram frequentemente afetados. Na localização cardíaca, a proliferação tumoral ocorria principalmente na base do coração, atingindo o átrio direito.
O aspecto macro e microscópico dos tumores das outras formas são semelhantes. Na forma tímica juvenil, o tumor transforma o timo numa massa volumosa, branca, firme, lobulada (Barros 2007Barros C.S.L. 2007. Doenças víricas: leucose bovina, p.159-169. In: Riet- Correa F., Schild A.L., Lemos R.A.A. & Borges J.R.J. (Eds), Doenças de Ruminantes e Eqüídeos. vol. 1. 3ª ed. Pallotti, Santa Maria.). Dependendo do órgão afetado diferentes lesões devem ser consideradas nos diagnósticos diferenciais, como hepatite, linfadenites inespecíficas, lipomatose muscular ou miosite crônica e dermatofitose na forma cutânea da leucose. São condenadas as carcaças, partes da carcaça ou órgão que apresentem tumores malignos, com ou sem metástase (Ministério da Agricultura 1980Ministério da Agricultura. 1980. Regulamento da Inspeção Industrial e Sanitária de Produtos de Origem Animal (R.I.I.S.P.O.A). Aprovado pelo decreto no. 30690 de 20.03.52, alterado pelo decreto nº 1255, de 25.06.52. Brasília. 66p.).
Carcinoma de células escamosas
Carcinoma de células escamosas (CCE) foi o segundo tumor mais frequentemente encontrado. CCE é um neoplasma relativamente comum, localmente invasivo e que afeta a maioria das espécies doméstica. Em bovinos, as raças Herford e Ayrshire são mais predispostas na face, pálpebras, orelhas, dorso e vulva (Mauldin & Peters-Kennedy 2016Mauldin E.A. & Peters-Kennedy J. 2016. Integumentary system, p.509-736. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.). Embora CCEs do trato digestivo sejam raros na maior parte das regiões do mundo (Uzal et al. 2016Uzal F.A., Plattner B.L. & Hostetter J.M. 2016 Alimentary system, p.1-257. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.2. 6th ed. Elsevier, St. Louis.), eles são comuns em certas regiões como no Sul do Brasil, associados a ingestão de samambaia; nessa região, perfazem 3-4% das necropsias em bovinos (Gava et al. 2002Gava A., Neves D.S., Gava D., Moura T.S., Schild A.L.& Riet-Correa F. 2002. Bracken fern (Pteridium aquilinum) poisoning in cattle in Southern Brazil. Vet. Human Toxicol. 44:362-365.). As metástases não são comuns e quando ocorrem geralmente atingem linfonodos regionais e pulmão (Gava et al. 2002Gava A., Neves D.S., Gava D., Moura T.S., Schild A.L.& Riet-Correa F. 2002. Bracken fern (Pteridium aquilinum) poisoning in cattle in Southern Brazil. Vet. Human Toxicol. 44:362-365.). CCEs de pele são associados a mutações no gene p53 induzidas por radiação ultravioleta (Mauldin & Peters-Kennedy 2016Mauldin E.A. & Peters-Kennedy J. 2016. Integumentary system, p.509-736. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.).
Dez CCEs foram encontrados neste estudo, ou 15% do total de tumores. Cinco deles eram primários, três da pele que devem estar associados à exposição de raios UV e dois eram localizados no trato digestivo superior, e devem estar associados a intoxicação por samambaia. Os outros cinco eram metástases em linfonodos e/ou pulmão.
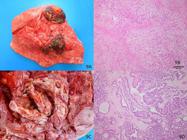
Os achados macroscópicos dos CCEs deste estudo podem ser classificados em dois tipos: produtivos ou erosivos. Os primeiros tinham crescimento papilar de tamanho variável e superfície ulcerada e sangravam com facilidade. Nos erosivos havia ulcerações que se tornavam profundas e formavam crateras. Na superfície de corte desses tumores, frequentemente se observavam áreas irregulares de consistência firme, brancas ou com pontos amarelo-ouro que correspondiam a áreas de ceratinização (Fig.2A).
Carcinoma de células escamosas. (A) Esôfago, secção transversal. Massa irregular, branca-amarelada, lobulada envolvendo o esôfago (estrutura tubular localizada na porção superior esquerda da foto). Os focos amarelo-ouro dispersos na massa tumoral correspondem às áreas de ceratinização. (B) Histopatologia do tumor mostrado em A. Observam-se ninhos de células escamosas de citoplasma abundante, circundados por acentuada reação desmoplásica e células inflamatórias mononucleares e alguns neutrófilos. No centro dos ninhos observa-se ceratina produzida pelas células neoplásicas em diferentes estágios de desenvolvimento. Em alguns ninhos a ceratina forma camadas concêntricas fortemente eosinofílicas (pérolas de ceratina). HE, obj.20x.
Microscopicamente os tumores eram formados por ninhos de células escamosas de abundante citoplasma rodeadas por extensa desmoplasia e infiltrado inflamatório. Alguns apresentavam pérolas de ceratina (as áreas amarelas observadas macroscopicamente) (Fig. 2 B). Alguns tumores apresentavam pouca ceratinização restrita a ceratinócitos individuais.
Metástases de CCEs em linfonodos podem adquirir um aspecto semelhante ao da tuberculose caseo-calcária; isso deve ser considerado no diagnóstico diferencial. Actinobacilose também deve ser considerada no diagnóstico diferencial. Em um dos nossos casos, em que havia lesão nos linfonodos da cabeça, o diagnóstico macroscópico inicial foi de actinobacilose (Tessele et al. 2014Tessele B., Martins T.B., Vielmo A. & Barros C.S.L. 2014. Lesões granulomatosas encontradas em bovinos abatidos para consumo. Pesq. Vet. Bras. 38:763-769.). Os focos amarelos de pus em meio aos granulomas da actinobacilose são facilmente confundíveis com os pontos amarelados de ceratina do CCE.
Feocromocitoma
Feocromocitomas são tumores neuroendócrinos de células cromafins da adrenal (Wright & Conner 1968Wright B.J. & Conner G.H. 1968. Adrenal neoplasms in slaughtered cattle. Cancer Res. 28:251-263.) que secretam catecolaminas (epinefrina, norepinefrina ou ambas). São os neoplasmas mais comuns da medular da adrenal de animais. Ocorrem com maior frequência em bovinos e cães e, infrequentemente, em outras espécies (Rosol & Gröne 2016Rosol T.J. & Gröne A. 2016. Endocrine glands, p.269-357. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.). Isso foi confirmado neste estudo onde os feocromocitomas representaram 12% de todos os tumores encontrados e 1,5% do total de 544 lesões.
Feocromocitomas malignos invadem a cápsula da adrenal e atravessam a parede da veia cava caudal formando um grande trombo que oclui parcialmente a parede da cava comprometendo o retorno sanguíneo das extremidades caudais. Metástases podem afetar o fígado, linfonodos regionais, baço e pulmões (Rosol & Gröne 2016Rosol T.J. & Gröne A. 2016. Endocrine glands, p.269-357. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.). Em pelo menos três casos dos oito relatados neste estudo ocorreram metástases, duas no pulmão e uma em linfonodo ilíaco. Feocromocitomas podem ser unilaterais ou bilaterais e têm maior incidência na glândula do lado esquerdo (Wright & Conner 1968Wright B.J. & Conner G.H. 1968. Adrenal neoplasms in slaughtered cattle. Cancer Res. 28:251-263.). Todos os casos deste estudo eram unilaterais, o que é o mais comum (Wright & Conner 1968Wright B.J. & Conner G.H. 1968. Adrenal neoplasms in slaughtered cattle. Cancer Res. 28:251-263.). Não foi possível determinar se o lado esquerdo estava mais representado. Uma técnica simples para auxiliar no diagnóstico macroscópico de feocromocitomas é a reação cromafim de Henle, isto é, a aplicação de solução de Zenker na superfície de corte de um tumor fresco seccionado recentemente resulta em oxidação das catecolaminas formando um pigmento marrom em cerca de 20 minutos (Rosol & Gröne 2016Rosol T.J. & Gröne A. 2016. Endocrine glands, p.269-357. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.). Todos os casos deste estudo foram achados incidentais. Isso era esperado, uma vez que feocromocitomas funcionais são raros em bovinos (Rosol & Gröne 2016Rosol T.J. & Gröne A. 2016. Endocrine glands, p.269-357. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.).
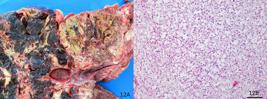
Em todos os casos deste estudo o tumor apresentou-se como uma massa castanho-avermelhada com áreas de hemorragia e necrose, próxima ao rim (Fig.3A). Na dissecção do tecido tumoral observavam-se, na maioria dos casos, áreas com tecido ósseo, o que é esperado nesses tumores (Pereira et al. 2007Pereira W.L.A., Silva A.W.C. & Pinto M.N. 2007. Feocromocitoma em bovinos de abate: relatos de casos. Arq. Bras. Med. Vet. Zootec. 59:301-305.). Microscopicamente, as células tumorais podem ser de três tipos: (1) células grandes com núcleo oval, lembrando células hiperplásicas da medular, (2) células fusiformes com núcleo pequeno alongado e hipercromático e (3) células altamente pleomórficas com vários núcleos bizarros (Wright & Conner 1968Wright B.J. & Conner G.H. 1968. Adrenal neoplasms in slaughtered cattle. Cancer Res. 28:251-263.). O citoplasma é fracamente eosinofílico, finamente granular e os limites citoplasmáticos são frequentemente indistintos devido à autólise precoce da medular da adrenal (Rosol & Gröne 2016Rosol T.J. & Gröne A. 2016. Endocrine glands, p.269-357. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.). Frequentemente uma mistura desses tipos de células, incluindo células nervosas imaturas, é observada, embora usualmente com predominância de um dos tipos celulares. Independentemente do tipo celular, o arranjo da arquitetura consiste de cordões ou pacotes circundados por canais vasculares (Fig.3B), como observado em todos os casos deste estudo. Necrose e mineralização foram observadas com frequência.
Feocromocitoma, adrenal. (A) Massa castanho-avermelhada, com áreas de necrose e hemorragia e cavitações multifocais localizada próxima ao rim. Essa massa tinha 20x17x7 cm e pesava 1,5Kg. Ao corte a faca rangia devido ao tecido ósseo em meio ao tumor. (B) Histopatologia de A. Observam-se pacotes de células neoplásicas separados por finos septos de tecido conjuntivo fibroso e circundados por canais vasculares. As células possuem citoplasma alongado, com o núcleo pequeno, alongado e hipercromático. HE, obj.20x.
A causa dos feocromocitomas em animais domésticos é desconhecida. A maioria dos tumores é esporádica, mas parece ocorrer uma predisposição familiar, especialmente em bovinos. Em ratos, a estimulação crônica da medular da adrenal por estresse e hipercalcemia aumenta a incidência de feocromocitomas. (Rosol & Gröne 2016Rosol T.J. & Gröne A. 2016. Endocrine glands, p.269-357. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.)
Nos frigoríficos pesquisados neste estudo, esse tumor era, na rotina, incorretamente interpretado ou negligenciado. Após o surgimento dos primeiros casos e orientação dada aos inspetores veterinários sobre os aspectos macroscópicos do tumor, o índice de acerto passou a ser de 100%.
Carcinoma de células renais
Três casos de carcinoma renal foram detectados, um deles com metástases para o pulmão. Tumores renais primários são pouco frequentes em qualquer das espécies domésticas. Dentro dessa baixa frequência, carcinomas de células renais (CCRs) são os mais comuns (Cianciolo & Mohr 2016Cianciolo R. & Mohr F.C. 2016. Urinary system, p.376-464. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. Vol.2. 6th ed. Elsevier, St. Louis.). Num levantamento em abatedouros incluindo 1.300.000 e 13.500 bovinos de abatedouros respectivamente na Grã-Bretanha (Sandison & Anderson 1968Sandison A.T. & Anderson L.J. 1968. Tumors of the kidney in cattle, sheep, and pigs. Cancer 21:727-742.) e nos EUA (Kelley et al. 1996Kelley L.C., Crowell W.A., Puette M., Langheinrich K.A. & Self A.D. 1996. A retrospective study of multicentric bovine renal cell tumors. Vet. Pathol. 33:133-141.) apenas 0,06% na Grã Bretanha e 0,15% nos EUA eram carcinomas de células renais (CCRs). Neste levantamento, das 544 lesões diagnosticadas 0,6% eram CCRs, o que confirma que a prevalência desses tumores é uniformemente baixa em vários países. Ao contrário do que ocorre em cães, nos bovinos os CCRs são mais comuns em fêmeas do que em bovinos machos, provavelmente devido à vida mais longa das vacas quando comparadas aos machos dessa espécie (Cianciolo & Mohr 2016Cianciolo R. & Mohr F.C. 2016. Urinary system, p.376-464. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. Vol.2. 6th ed. Elsevier, St. Louis.). Nos casos deste estudo, o sexo dos animais afetados não foi informado.
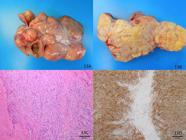
Em bovinos as metástases são raras e, quando ocorrem, afetam os pulmões (Cianciolo & Mohr 2016Cianciolo R. & Mohr F.C. 2016. Urinary system, p.376-464. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. Vol.2. 6th ed. Elsevier, St. Louis.), semelhantemente ao que ocorreu em um dos nossos casos. Alguns CCRs de bovinos ocorrem bilateralmente sem metástases em outros órgãos - a chamada síndrome bilateral sincrônica - quando os tumores iniciam independentemente em cada um dos rins (Cianciolo & Mohr 2016Cianciolo R. & Mohr F.C. 2016. Urinary system, p.376-464. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. Vol.2. 6th ed. Elsevier, St. Louis.). Nos três casos do presente estudo, apenas um rim de cada bovino foi afetado. Em todos os três bovinos afetados o rim estava aumentado de tamanho com parênquima substituído por áreas brancacentas firmes com focos amarelos e intercaladas por cistos. Num dos casos havia intensa necrose da gordura perirrenal (Fig.4). A maior parte da massa tumoral era localizada na cortical do rim e se estendia além da superfície capsular.
Carcinoma de células renais. O parênquima renal foi substituído por tecido brancacento e firme em meio ao qual veem-se focos amarelos e cistos contendo material líquido marrom (pus). A gordura perirrenal está endurecida e apresenta-se parcialmente mineralizada (necrose da gordura).
O padrão macroscópico e histológico dos três tumores descritos aqui são característicos de CCRs (Kelley et al. 1996Kelley L.C., Crowell W.A., Puette M., Langheinrich K.A. & Self A.D. 1996. A retrospective study of multicentric bovine renal cell tumors. Vet. Pathol. 33:133-141., Cianciolo & Mohr 2016Cianciolo R. & Mohr F.C. 2016. Urinary system, p.376-464. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. Vol.2. 6th ed. Elsevier, St. Louis.).
Lipoma
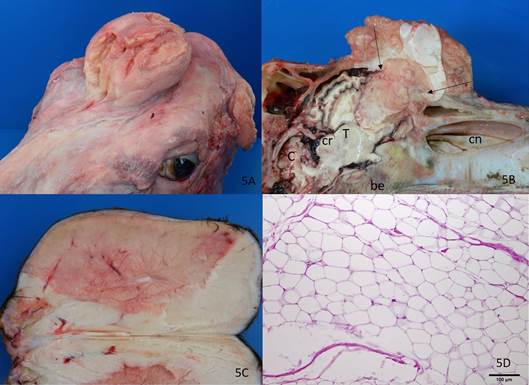
Lipomas são neoplasmas benignos de adipócitos observados na maioria dos animais domésticos (Goldschmidt & Hendrick 2002Goldschmidt M.H. & Hendrick M.J. 2002. Tumors of skin and soft tissues, p.45-118. In: Meuten D.J. (Ed.), Tumours in Domestic Animals. 4th ed. Iowa State Press, Ames.). Neste estudo, foram observados três casos de lipoma, dois no tecido subcutâneo e outro de localização intracraniana. Lipomas são raros em bovinos e, geralmente, localizam-se em órgãos internos. Lipomas intracranianos são tumores ainda mais raros e, na maioria dos casos, envolvem o corpo caloso (Zettner & Netsky 1960Zettner A. & Netsky M. 1960. Lipoma of the corpus callosum. J. Neuropathol. Exper. Neurol. 19:305-319.). Lipoma do corpo caloso é uma malformação congênita que pode iniciar de uma anomalia na diferenciação dos tecidos embrionários primitivos, relacionados ao fechamento imperfeito do tubo neural ((Zettner & Netsky 1960Zettner A. & Netsky M. 1960. Lipoma of the corpus callosum. J. Neuropathol. Exper. Neurol. 19:305-319.).
Acredita-se que lipomas intracranianos originam-se das células da gordura presentes nas leptomeninges ou nas células da pia primitiva devido a malformação durante o desenvolvimento (Peterman et al. 1984Peterman S.B., Steiner R.E. & Bydder G.M. 1984. Magnetic resonance imaging of intracranial tumors in children and adoleseents. Amer. J. Neuroradiol. 5:703-709.). O lipoma intracraniano do bovino deste caso apresentou aspecto semelhante ao descrito na literatura (Fig.5A,B). No osso frontal havia uma fenda, que foi interpretada como um defeito disráfico. Ao corte longitudinal da cabeça, observava-se que a massa, semelhante à gordura, se estendia cranialmente da região do corpo caloso para o exterior da cavidade craniana através da fenda. Os dois lipomas subcutâneos estavam localizados na região do flanco e na região lombar; esse último era pedunculado com pequeno fragmento de tecido cartilaginoso central (Fig.5C). Microscopicamente, as células possuíam o citoplasma vacuolizado e o núcleo periférico e alongado, semelhantes a lipócitos maduros (Fig.5D), o que é descrito para esse neoplasma (Gopal & Leipold 1979Gopal T. & Leipold H.W. 1979. Lipomeningocele in a calf. Vet. Pathol. 16:610-612.). Na lista de diagnósticos diferenciais do lipoma devem ser incluídos sua variante maligna (lipossarcoma), o cisto epidermoide, o teratoma, e o mielolipoma (Goldschmidt & Hendrick 2002Goldschmidt M.H. & Hendrick M.J. 2002. Tumors of skin and soft tissues, p.45-118. In: Meuten D.J. (Ed.), Tumours in Domestic Animals. 4th ed. Iowa State Press, Ames.).
Lipoma. (A) Protraindo pelo osso frontal há uma massa de aproximadamente 15 cm de diâmetro de aspecto semelhante à gordura (B) Ao corte longitudinal da cabeça, observa-se que a massa se estende da região do tálamo (T) até a superfície externa do osso frontal, passando por uma fenda (setas), interpretada como um defeito disráfico (craniósquise), e comprimindo o telencéfalo. No centro, a massa é constituída por material cartilaginoso. Cn = cavidade nasal; Cr = colículo rostral; be = osso basoesfenoide; C = cerebelo. (C) Lipoma da região lombar de um bovino. Massa semelhante à gordura recoberta por pele. No centro da massa há um pequeno fragmento de tecido cartilaginoso. A diferença de coloração observada na fotografia é devido ao congelamento do material. (D) Histopatologia de A-B. Células neoplásicas com o citoplasma bem definido e vacuolizado, e núcleo deslocado para a periferia, semelhante a lipócitos maduros. HE, obj.20x.
Tumores hepáticos (adenoma, carcinoma hepatocelular e colangiocarcinoma)
Os tumores hepáticos estão entre os neoplasmas mais comuns de bovinos (Cullen & Popp 2002Cullen J.M. & Popp J.A. 2002. Tumors of the liver and gall bladder, p.483-508. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames .). Tumores hepatocelulares (adenomas e carcinomas) e colangiocarcinomas são os mais frequentes (Kenny 1944Kenny J.E. 1944. Some observations on bovine neoplasia. Vet. Rec. 56:69-71., Anderson & Sandison 1967Anderson L.J. & Sandison A.T. 1967. Tumors of the liver in cattle, sheep, and pigs. Cancer 21:289-301.). Sua etiologia em animais domésticos é desconhecida.
Adenomas hepatocelulares são usualmente solitários, marrom-amarelados ou vermelho-escuros, com 2-8 cm de diâmetro e bem demarcados do tecido hepático adjacente; no entanto, não são encapsulados. Nunca são mais firmes que o parênquima normal, uma vez que não há aumento de tecido fibroso e raramente apresentam necrose ou hemorragia (Cullen & Popp 2002Cullen J.M. & Popp J.A. 2002. Tumors of the liver and gall bladder, p.483-508. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames .). Carcinomas hepatocelulares podem ser vistos como massas solitárias bem demarcadas no parênquima hepático (Anderson & Sandison 1967Anderson L.J. & Sandison A.T. 1967. Tumors of the liver in cattle, sheep, and pigs. Cancer 21:289-301.), mas em crescimentos avançados, quase todo o parênquima é substituído pelo tumor. Colangiocarcinomas podem ter uma aparência massiva ou multinodular e são frequentemente umbilicados. A superfície é branca, branco-acinzentada ou marrom-amarelada. Os colangiocarcinomas são firmes devido à desmoplasia acentuada (Cullen & Popp 2002Cullen J.M. & Popp J.A. 2002. Tumors of the liver and gall bladder, p.483-508. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames .). Pulmões, linfonodos abdominais e torácicos, e peritônio são frequentes sítios de metástases (Anderson & Sandison 1967Anderson L.J. & Sandison A.T. 1967. Tumors of the liver in cattle, sheep, and pigs. Cancer 21:289-301.). No caso desse estudo, metástases do colangiocarcinoma foram observadas nos pulmões. O adenoma, o carcinoma e o colangiocarcinoma observados no fígado apresentaram padrões macroscópicos semelhantes ao descrito na literatura (Cullen & Popp 2002Cullen J.M. & Popp J.A. 2002. Tumors of the liver and gall bladder, p.483-508. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames .). Microscopicamente, adenomas hepatocelulares são bem demarcados do parênquima adjacente que sofre atrofia por pressão. Os hepatócitos apresentam uma aparência uniforme, e podem ser vacuolizados e maiores que os hepatócitos normais. Uma característica consistente dos adenomas é a ausência de uma veia centrolobular e de mais de uma tríade portal (Cullen & Popp 2002Cullen J.M. & Popp J.A. 2002. Tumors of the liver and gall bladder, p.483-508. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames .); esse aspecto foi observado no caso descrito aqui. Carcinomas hepatocelulares são arranjados em ilhas sólidas ou lóbulos ou em trabéculas bem definidas, separadas por sinusoides (Anderson & Sandison 1967Anderson L.J. & Sandison A.T. 1967. Tumors of the liver in cattle, sheep, and pigs. Cancer 21:289-301.). Em nosso caso, as células arranjaram-se em lóbulos e em torno deles, em algumas áreas, havia abundante tecido fibroso. Nos carcinomas hepatocelulares, as células tumorais mostram uma semelhança inconfundível com as células hepáticas normais, com grandes irregularidades na forma e no tamanho. O citoplasma das células tumorais é usualmente mais basofílico que o dos hepatócitos normais. O estroma geralmente é escasso e visto mais na periferia do crescimento (Kenny 1944Kenny J.E. 1944. Some observations on bovine neoplasia. Vet. Rec. 56:69-71.). Raramente evidencia-se cirrose em bovinos com carcinomas hepatocelulares (Cullen & Popp 2002Cullen J.M. & Popp J.A. 2002. Tumors of the liver and gall bladder, p.483-508. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames .). Essencialmente, os colangiocarcinomas são compostos de pequenos ácinos de epitélio colunar ou cuboide baixo e algum grau de reação cirrótica está sempre presente (Anderson & Sandison 1967Anderson L.J. & Sandison A.T. 1967. Tumors of the liver in cattle, sheep, and pigs. Cancer 21:289-301.). Frequentemente há abundante proliferação de ductos biliares (Kenny 1944Kenny J.E. 1944. Some observations on bovine neoplasia. Vet. Rec. 56:69-71.). No bovino deste caso, havia abundante proliferação de tecido conjuntivo fibroso em torno de ilhas de células neoplásicas, muitas delas formando estruturas semelhante a ácinos.
Tumor de células da granulosa
O tumor de células da granulosa (TCG) é o tipo mais comum de tumor ovariano dos cordões sexuais sendo composto primariamente por células que relembram as células da granulosa do folículo (Santos et al. 2011Santos R.L., Nascimento E.F. & Edwards J. 2011. Sistema reprodutivo feminino, p.798-854. In: Santos R.L. & Alessi A.C. (Ed.), Patologia Veterinária. Roca, São Paulo.). Alguns autores sugerem que o uso do termo "tumor do cordão sexual-estromal" é mais apropriado devido às incertezas sobre a origem embriológica e histogênica das células nesses tumores (Maclachlan & Kennedy 2002Maclachlan N.J. & Kennedy P.C. 2002. Tumors of the genital systems, p.547-573. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames.). Metástases de TCG malignos em vacas não são incomuns e tendem a ocorrer tardiamente por disseminação hematógena ou, raramente, por implantação na cavidade peritoneal (Maclachlan & Kennedy 2002Maclachlan N.J. & Kennedy P.C. 2002. Tumors of the genital systems, p.547-573. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames.).
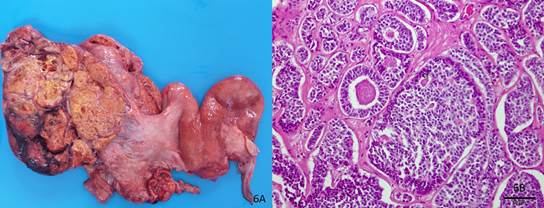
TCGs podem apresentar diversos tamanhos e pesos, podendo originar-se de qualquer dos ovários, porém raramente são bilaterais (Maclachlan & Kennedy 2002Maclachlan N.J. & Kennedy P.C. 2002. Tumors of the genital systems, p.547-573. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames.). Os três casos desse estudo foram observados afetando apenas um ovário e metástases não foram encontradas. Os tumores apresentaram-se como massas grandes (um deles possuía 25 cm de diâmetro), lobuladas, firmes e com a superfície de corte branca-amarelada, com áreas císticas dilatadas, algumas com coágulos sanguíneos, e necrose (Fig.6A), semelhante ao que é relatado na literatura (Maclachlan & Kennedy 2002Maclachlan N.J. & Kennedy P.C. 2002. Tumors of the genital systems, p.547-573. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames., Santos et al. 2011Santos R.L., Nascimento E.F. & Edwards J. 2011. Sistema reprodutivo feminino, p.798-854. In: Santos R.L. & Alessi A.C. (Ed.), Patologia Veterinária. Roca, São Paulo.).
Ovário. Tumor de células da granulosa. (A) Há alteração da arquitetura ovariana por uma massa de, aproximadamente, 25 cm de diâmetro, com múltiplos nódulos amarelos, separados por finos septos de um tecido brancacento. No centro desses nódulos observam-se pequenos cistos preenchidos por líquido amarelo claro ou coágulos sanguíneos. (B) Histopatologia de A. As células da granulosa neoplásicas formam estruturas que lembram folículos ovarianos, separadas por finos septos de tecido conjuntivo fibroso, muitas delas contendo material proteináceo no centro, estruturas morfologicamente compatíveis com corpúsculos de Call-Exner (CE).
Microscopicamente, observam-se acúmulos irregulares de células da granulosa neoplásicas, muitas vezes arranjadas em estruturas que lembram folículos, separadas por um estroma de células fusiformes (Maclachlan & Kennedy 2002Maclachlan N.J. & Kennedy P.C. 2002. Tumors of the genital systems, p.547-573. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames.). Corpúsculos de Call-Exner - que consistem de células tumorais agrupadas ao redor de espaços claros ou focos de material proteináceo - podem ocorrer em alguns TCG, principalmente naqueles com características microfoliculares (Maclachlan & Kennedy 2002Maclachlan N.J. & Kennedy P.C. 2002. Tumors of the genital systems, p.547-573. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames., Santos et al. 2011Santos R.L., Nascimento E.F. & Edwards J. 2011. Sistema reprodutivo feminino, p.798-854. In: Santos R.L. & Alessi A.C. (Ed.), Patologia Veterinária. Roca, São Paulo.). Esses corpúsculos foram observados nos três casos desse estudo, o que favoreceu o diagnóstico definitivo (Fig.6B). TCG deve ser diferenciado de outros tumores do cordão sexual-estromal, uma vez que esses neoplasmas frequentemente apresentam tipos celulares múltiplos no mesmo tumor (Maclachlan & Kennedy 2002Maclachlan N.J. & Kennedy P.C. 2002. Tumors of the genital systems, p.547-573. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames.).
Leiomioma uterino
Leiomioma é um tumor benigno de músculo liso. Em bovinos, tanto leiomiomas quanto sua variante maligna (leiomiossarcoma) são comumente diagnosticados no trato genital feminino (Schlafer & Foster 2016Schlafer D.H. & Foster R.A. 2016. Female genital system, p.258-464. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.). Leiomiomas uterinos originam-se do miométrio e são frequentemente achados incidentais ocorrendo em animais adultos, porém várias faixas etárias podem ser afetadas (Anderson & Sandison 1967Anderson L.J. & Sandison A.T. 1967. Tumors of the liver in cattle, sheep, and pigs. Cancer 21:289-301.). Em nossos casos não foi possível ter acesso aos dados referentes a idade das vacas. São tumores solitários ou múltiplos, bem circunscritos, ovoides e firmes. Nos dois casos encontrados neste estudo, a massa estava localizada no endométrio, na altura do corpo uterino, possuía aproximadamente 10 cm de diâmetro e era firme e brancacenta (Fig.7A). Conforme é descrito na literatura (Cooper & Valentine 2002Cooper B.J. & Valentine B.A. 2002. Tumors of muscle, p.319-363. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames.), não eram encapsulados e ulceração e necrose são características ausentes. Microscopicamente, consistiam de uma população homogênea de células alongadas densamente arranjadas em fascículos interlaçados, mimetizando o tecido muscular normal (Fig.7B). Leiomiomas uterinos geralmente não são associados com sinais clínicos, embora possam interferir com a capacidade reprodutiva (Cooper & Valentine 2002Cooper B.J. & Valentine B.A. 2002. Tumors of muscle, p.319-363. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames.).
Leiomioma uterino (A) Útero. Há uma massa aderida de ≅10 cm de diâmetro, brancacenta e homogênea localizada no miométrio do corpo uterino. (B). Histopatologia de A. População homogênea de células alongadas densamente arranjadas em fascículos interlaçados, mimetizando o tecido muscular normal. HE, obj.20x.
Há evidências que leiomiomas no trato genital de fêmeas possuam uma base hormonal (Cooper & Valentine 2002Cooper B.J. & Valentine B.A. 2002. Tumors of muscle, p.319-363. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames.). Em bovinos, leiomiomas devem ser diferenciados macroscopicamente de linfomas devido à aparência firme, branco-amarelada homogênea e discretamente lobulada.
Neurofibroma
Neurofibroma é descrito (Cantile e Youssef 2016Cantile C. & Youssef S. 2016. Nervous system, p.250-406. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. Vol.2. 6th ed. Elsevier, St. Louis.) como um tumor benigno composto de uma população mista de células neoplásicas, incluindo células de Schwann, células perineurais e fibroblastos, com uma proporção variável de fibras colágenas e matriz mucoide. Os núcleos das células neoplásicas são ovais ou fusiformes.
Em bovinos, a neurofibromatose é uma forma multicêntrica de schwannoma, comum em bovinos velhos em abatedouro, mas também tem sido observada em animais jovens. A pele pode ser afetada, mas as lesões são usualmente restritas aos nervos mais profundos da parede torácica das vísceras. Os sítios anatômicos mais frequentemente afetados incluem o plexo braquial, nervos intercostais, plexo hepático autonômico, plexo epicárdico e nervos autonômicos do mediastino. Os gânglios simpáticos, especialmente os gânglios estrelados e outros gânglios do tórax são também frequentemente envolvidos. Os nervos afetados são espessados, e podem apresentar nódulos firmes e cinzentos. Os gânglios afetados podem estar vários centímetros aumentados e ter, ao corte, um aspecto lobulado (Cantile e Youssef 2016Cantile C. & Youssef S. 2016. Nervous system, p.250-406. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. Vol.2. 6th ed. Elsevier, St. Louis.).
Os casos de neurofibroma (ou schwannoma) deste estudo possuíam localização epicárdica e periauricular, que são alguns dos sítios de predileção para o desenvolvimento desse tipo de tumor. O neurofibroma epicárdico apresentou-se como um nódulo de 2 cm localizado no ápice do coração; já o da base da orelha possuía cerca de 20x20x10 cm. Em ambos os casos, as massas possuíam aspecto gelatinoso, eram brilhantes e se assemelhavam à gordura, às vezes apresentando um aspecto multilobulado, com áreas de hemorragia. A microscopia era semelhante à descrita na literatura. É muito provável que os dois neurofibromas aqui descritos sejam parte da neurofibromatose bovina, embora isso seja difícil confirmar, já que nem toda a carcaça foi examinada à procura de outros nódulos (Cantile & Youssef 2016Cantile C. & Youssef S. 2016. Nervous system, p.250-406. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. Vol.2. 6th ed. Elsevier, St. Louis.).
Papiloma
Papilomas são neoplasmas epiteliais benignos conhecidos como "verrugas". Na grande maioria das vezes são causados pela infecção de um Papillomavirus (família Papillomaviridae) espécie-específico e, frequentemente, sítio anatômico-específico (Mauldin & Peters-Kennedy 2016Mauldin E.A. & Peters-Kennedy J. 2016. Integumentary system, p.509-736. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.). Treze Papillomavirus bovino (BPV) foram descritos nessa espécie como causa de papilomas e/ou fibropapilomas - uma variante que consiste na proliferação de tecido fibroso coberto por epitélio hiperplásico e hiperceratótico - (Mauldin & Peters-Kennedy 2016Mauldin E.A. & Peters-Kennedy J. 2016. Integumentary system, p.509-736. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.). A papilomatose bovina pode ser um problema de rebanho, pois o vírus pode ser facilmente transmitido de animal para animal ou através de fômites. Dependendo do sítio anatômico de desenvolvimento e do tipo de papiloma envolvido o padrão biológico e morfológico das lesões pode variar (Quadro 4). Por exemplo, o BPV-1 tipicamente causa fibropapilomas nos tetos e no pênis, enquanto BPV-2 causa fibropapilomas na cabeça, barbela, pescoço, paleta e, ocasionalmente, membros e teto. Ambos os vírus produzem lesões múltiplas em bovinos com menos de 2 anos de idade e as lesões, frequentemente, regridem espontaneamente (Grist 2008Grist A. 2008. Bovine Meat Inspection: Anatomy, Physiology and Disease Conditions. 2nd ed. Nottingham University Press, Nottingham.). Em conjunto, com BPVs (BPV-l, BPV-2, e BPV-4), a ingestão de samambaia (Pteridium aquilinum) é associada com vários tipos de tumores na bexiga e no trato alimentar (Mauldin & Peters-Kennedy 2016Mauldin E.A. & Peters-Kennedy J. 2016. Integumentary system, p.509-736. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.). Bovinos que pastoreiam em áreas altamente infestadas por samambaia no Sul do Brasil, frequentemente, são acometidos por papilomatose alimentar e por carcinomas de células escamosas no trato alimentar superior (Gava et al 2002Gava A., Neves D.S., Gava D., Moura T.S., Schild A.L.& Riet-Correa F. 2002. Bracken fern (Pteridium aquilinum) poisoning in cattle in Southern Brazil. Vet. Human Toxicol. 44:362-365.).
Tipos de papilomavírus (BPV) causadores da papilomatose bovina (Maulding & Peters-Kennedy2016Mauldin E.A. & Peters-Kennedy J. 2016. Integumentary system, p.509-736. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.)
Os casos de papilomatose observados nesse estudo estavam localizados no rúmen (um caso) e nos tetos de uma vaca (um caso). A localização ruminal caracterizou-se pela formação de papilomas císticos (Fig.8C), enquanto os papilomas no teto formavam estruturas brancacentas, as quais se estendiam para a pele da região adjacente (Fig.8A,B). Inicialmente há o crescimento lento de pequenos nódulos que se transformam em massas com aspecto de couve-flor. Histologicamente os neoplasmas consistiam de múltiplas projeções papilares de espessura variada, recobertas por epitélio escamoso estratificado acantótico com espessa camada córnea ortoceratótica (Fig.8D).
Papilomatose. (A e B) Tetos. (A) Há múltiplas estruturas papilares brancacentas, que se estendem para a pele adjacente. (B) Maior aproximação da lesão em A. (C) Rúmen. Papilomas císticos na mucosa. (D) Histopatologia de A. Projeção papilar de espessura variada, recoberta por epitélio escamoso estratificado acantótico com espessa camada córnea ortoceratótica. HE, obj.20x
Paradoxalmente, os papilomas representaram apenas 3% de todos os tumores, pois se sabe que são tumores comuns em bovinos (Mauldin & Peters-Kennedy 2016Mauldin E.A. & Peters-Kennedy J. 2016. Integumentary system, p.509-736. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.). Sua baixa representação neste estudo pode ser explicada pelo fato de que esses tumores não são usualmente diagnosticados no exame post mortem - quando o couro já foi retirado da carcaça - o que foi o procedimento na maioria dos casos aqui observados, mas sim no exame ante mortem.
Tumores pulmonares primários
Tumores epiteliais primários de pulmões de bovinos (Quadro 5) são usualmente observados como um achado incidental no abatedouro. Carcinomas são o neoplasma epitelial primário mais comuns em bovinos (Caswell & Williams 2016Caswell J.L. & Williams K.J. 2016. Respiratory system, p.465-591. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.), especialmente adenocarcinomas e os carcinomas de células escamosas (Anderson & Sandison 1967Anderson L.J. & Sandison A.T. 1967. Tumors of the liver in cattle, sheep, and pigs. Cancer 21:289-301.). Adenocarcinomas pulmonares são derivados das células alveolares, das glândulas bronquiais ou do epitélio dos bronquíolos (Caswell & Williams 2016Caswell J.L. & Williams K.J. 2016. Respiratory system, p.465-591. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.). A etiologia dos tumores pulmonares primários em bovinos é desconhecida.
Classificação dos tumores epiteliais primários do pulmão de bovinos (Caswell & Williams 2016Caswell J.L. & Williams K.J. 2016. Respiratory system, p.465-591. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.)
Há poucos relatos de carcinoma de pequenas células (CPPCs) em bovinos (Caswell & Williams 2016Caswell J.L. & Williams K.J. 2016. Respiratory system, p.465-591. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.). Podem apresentar-se como massas grandes e firmes, podendo ocupar até um terço da cavidade torácica (Piercy et al. 1993Piercy D.W., Cranwell M.P. & Wonnacott B.J. 1993. Anaplastic small cell carcinoma of the lung in a six-month-old Friesian calf. Vet Rec. 132:386-387.). Um dos tumores epiteliais primários do pulmão neste estudo era morfologicamente compatível com CPPC, o outro era um adenocarcinoma. O CPPC apresentava múltiplos nódulos macios ao corte, amarelos ou vermelhos, distribuídos aleatoriamente por todo o parênquima pulmonar (Fig.9A). O adenocarcinoma apresentou-se como uma massa solitária afetando apenas um lobo pulmonar. Ao corte era firme, brancacento e com pequenos cistos (Fig.9C).
Tumores pulmonares primários. (A). Carcinoma pulmonar de pequenas células (CPPC). Nódulos amarelos recobertos por coágulos sanguíneos, distribuídos aleatoriamente por todo parênquima pulmonar. (B) Histopatologia de A mostrando células redondas ou fusiformes formando um manto difuso e frouxo, sustentado por um escasso estroma fibrovascular. HE, obj.10x. (C) Adenocarcinoma pulmonar. A massa afetava apenas um lobo pulmonar e apresenta múltiplos cistos ao corte. (D) Histopatologia de C. Observam-se células neoplásicas formando projeções papilíferas circundadas por um estroma fibroso. Há ácinos pulmonares dilatados multifocalmente. HE, obj.20x.
Os CPPC em animais são assim classificados baseados na similaridade histológica aos CPPC de humanos (Stünzi et al. 1974Stünzi H., Head K.W. & Nielsen S.W. 1974. Tumours of lungs. Bull. Wld. Hlth. Org. 50:9-19.). São massas compostas por pequenas células neoplásicas com citoplasma escasso que pode ser redondo, fusiforme ou poligonal (Caswell & Williams 2016Caswell J.L. & Williams K.J. 2016. Respiratory system, p.465-591. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.). Neste caso, as células eram redondas ou fusiformes formando um manto difuso e frouxo, sustentado por um escasso estroma fibrovascular (Fig.9B). Os adenocarcinomas podem ser divididos em quatro padrões histológicos distintos: papilar, acinar, sólido e misto; os padrões papilar e acinar são os mais frequentes (Caswell & Williams 2016Caswell J.L. & Williams K.J. 2016. Respiratory system, p.465-591. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.). O adenocarcinoma desse caso foi classificado como papilar devido à formação de projeções papilíferas com múltiplas camadas para o interior de ácinos neoplásicos (Fig.9D). As células possuíam um citoplasma colunar e núcleo redondo a oval, com cromatina agregada e limites citoplasmáticos indistintos. Envolvendo essas áreas observavam-se feixes de tecido conjuntivo fibroso.
Algumas vezes pode ser difícil diferenciar, tanto no exame macro- quanto no microscópico, os tumores primários de pulmão de metástases pulmonares. Quando ilhotas maiores de células neoplásicas de CPPC apresentam necrose central, podem assemelhar-se a detritos ceratinizados, conduzindo a um falso diagnóstico de carcinoma de células escamosas.
Adenocarcinoma mamário
Um caso deste estudo era de adenocarcinoma mamário. A mama estava aumentada de tamanho com múltiplas massas amareladas de, aproximadamente, 20 cm de diâmetro, com áreas hemorrágicas intercaladas por áreas esverdeadas (Fig.10A). Microscopicamente, observaram-se células neoplásicas redondas a cuboides, com alta taxa mitótica (até 15 mitoses por campo de grande aumento), arranjadas frouxamente e ocasionalmente formando ácinos com centro necrótico e hemorrágico (Fig.10B). Septos espessos de tecido conjuntivo dividiam o parênquima tumoral em lóbulos.
Adenocarcinoma da glândula mamária (A). Múltiplas massas amareladas de, aproximadamente, 20 cm de diâmetro, com áreas hemorrágicas intercaladas por áreas esverdeadas (necrose). (B) Histopatologia de A. As células neoplásicas formam um manto frouxo e, ocasionalmente, ácinos com necrose e hemorragia central. HE, obj.20x.
Embora comuns em cães e gatos (Schlafer & Foster 2016Schlafer D.H. & Foster R.A. 2016. Female genital system, p.258-464. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.), neoplasmas da glândula mamária são raros em bovinos. Numa extensa revisão de tumores mamários na vaca, 22 tumores foram encontrados, dos quais apenas 5 eram adenocarcinomas (Povey & Osborne 1969Povey R.C. & Osborne A.D. 1969. Mammary gland neoplasia in the cow. A Review of the literature and report of a fibrosarcoma. Path. Vet. 6:502-512. ). Numa outra revisão incluindo casos compilados desde 1902, encontraram-se 41 tumores, apenas 10 deles carcinomas (Ford et al. 1989Ford T.S., Ross M.W., Acland H.M. & Madison J.B. 1989. Primary teat neoplasia in two yearling heifers. J. Am. Vet. Med. Assoc. 195:238-239.). Na rotina de inspeção pós-abate nos EUA, em 13 milhões de úberes bovinos analisados nenhum tumor foi detectado (United States Department of Agriculture, 1945United States Department of Agriculture. 1945. Yearbook, United States Department of Agriculture.). Esses dados são intrigantes quando se considera que vacas leiteiras são mantidas em produção por muitos anos e vivem muito além do que é considerada a "idade do câncer". Sugere-se que a lactação tenha efeito protetivo no desenvolvimento de tumores de mama em seres humanos (Lester 2015Lester S.C. 2015. The breast, p.1343-1070. In: Kumar V., Abbas A.K. & Aster J.C. Robbins and Cotran Pathological Basis of Disease, 9th ed. Elsevier Saunders, Philadelphia.); a lactação quase constante em vacas poderia oferecer uma proteção semelhante. Metástases de neoplasmas mamários na vaca são raras, podendo ocorrer para linfonodos, pulmões, fígado, diafragma, pleura, pericárdio, rins e peritônio (Povey & Osborne 1969Povey R.C. & Osborne A.D. 1969. Mammary gland neoplasia in the cow. A Review of the literature and report of a fibrosarcoma. Path. Vet. 6:502-512. ). No caso desse estudo, não foram observadas metástases.
Diagnósticos diferenciais para adenocarcinomas mamários devem incluir mastite, abscessos, hematomas, trauma seguido por cicatrizes, outros neoplasmas mamários epiteliais e mesenquimais e linfoma (Thibault et al. 1997Thibault S., Mikaelian I., Dubreuil P., Drolet R. & Couture Y. 1997. Mammary fibroadenoma in a heifer. Can Vet J. 38:785-786.).
Adenocarcinoma de endométrio
Dentre as espécies domésticas, o adenocarcinoma uterino ocorre mais frequentemente em bovinos (Schlafer & Foster 2016Schlafer D.H. & Foster R.A. 2016. Female genital system, p.258-464. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.), sendo encontrado incidentalmente durante a inspeção post mortem de vacas velhas, acima de seis anos de idade (Kenneth & Svend 1976Kenneth M. & Svend W.N. 1976. Tumours of the female genital tract. Bull World Health Organ. 53:217-226.). Neste estudo, foi observado um caso desse tumor, tendo sido submetida para exame histopatológico apenas sua metástase pulmonar. A etiologia dos adenocarcinomas uterinos em vacas é desconhecida As taxas de metástases para pulmões e linfonodos são relativamente altas em bovinos (Schlafer & Foster 2016Schlafer D.H. & Foster R.A. 2016. Female genital system, p.258-464. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.).
Esses tumores são nódulos, solitários ou múltiplos, duros, brancacentos e de tamanhos variáveis localizados na parede uterina. Há acentuada desmoplasia (Barros et al. 1978Barros C.S.L., Barros S.S., Santos M.N. & Abaid F. 1978. Adenocarcinoma de útero em bovino. Rev. Cento de Ciência Rurais. 8:277-281.) que leva a formação de umbilicações na superfície serosa (Schlafer & Foster 2016Schlafer D.H. & Foster R.A. 2016. Female genital system, p.258-464. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.). Muitas vezes, durante a inspeção no abatedouro, somente mínimas alterações macroscópicas são vistas no útero, o que pode explicar o fato do tumor primário deste caso ter passado despercebido na inspeção post mortem. A metástase era caracterizada por múltiplos nódulos amarelos de aproximadamente 0,5 cm de diâmetro no parênquima pulmonar. Os septos interlobulares estavam distendidos por ar.
Histologicamente, adenocarcinoma uterino de bovinos é um tumor acentuadamente desmoplásico que invade difusamente todas as camadas da parede uterina (Barros et al. 1978Barros C.S.L., Barros S.S., Santos M.N. & Abaid F. 1978. Adenocarcinoma de útero em bovino. Rev. Cento de Ciência Rurais. 8:277-281.). As células neoplásicas formam estruturas acinares e raramente projetam-se para o lúmen formando pequenas papilas (Kenneth & Svend 1976Kenneth M. & Svend W.N. 1976. Tumours of the female genital tract. Bull World Health Organ. 53:217-226.). Alguns ácinos podem assumir aspecto cístico, com restos necróticos, calcificados ou não, no seu interior (Barros et al. 1978Barros C.S.L., Barros S.S., Santos M.N. & Abaid F. 1978. Adenocarcinoma de útero em bovino. Rev. Cento de Ciência Rurais. 8:277-281.). As células neoplásicas formam um epitélio cúbico ou colunar baixo, com limites citoplasmáticos distintos e quantidades moderadas de citoplasma eosinofílico (Barros et al. 1978Barros C.S.L., Barros S.S., Santos M.N. & Abaid F. 1978. Adenocarcinoma de útero em bovino. Rev. Cento de Ciência Rurais. 8:277-281.).
Como muitas vezes o tumor primário passa despercebido à inspeção e apenas as metástases são observadas; elas apresentam a abundante desmoplasia que caracteristicamente acompanha os adenocarcinomas uterinos. Esse aspecto, observado neste caso, permitiu diferenciar adenocarcinoma uterino dos carcinomas primários de pulmão (Barros et al. 1978Barros C.S.L., Barros S.S., Santos M.N. & Abaid F. 1978. Adenocarcinoma de útero em bovino. Rev. Cento de Ciência Rurais. 8:277-281.).
Fibroma interdigital
Um caso de fibroma interdigital foi observado neste estudo. Os termos fibroma e hiperplasia interdigital referem-se à hiperplasia do tecido fibroso denso da pele interdigital e tecido subcutâneo que ocorrem em resposta à irritação crônica. Essa reação proliferativa também é chamada de tiloma ou gabarro; a prevalência varia de 0,5%- 80,92%. (Borges & Pitombo 2007Borges J.R.J. & Pitombo C.A. 2007. Doenças digitais de etiologia incerta ou secundárias: pododermatite do paradígito, p.519-522. In: Riet-Correa F., Schild A.L., Lemos R.A.A.& Borges J.R.J. (Eds), Doenças de Ruminantes e Eqüídeos. vol. 2. 3ª ed. Pallotti, Santa Maria.).
A causa pode estar associada à irritação crônica decorrente de traumas ou acúmulo de dejetos e lama (Cruz et al. 2001Cruz C.E.F., Driemeier D., Cerva C. & Corbellini L.G. 2001. Clinical and epidemiological aspects of bovine digital lesions in southern Brazil. Arq. Bras. Med. Vet. Zootec. 53:654-657.). Além disso, a predisposição genética dos mestiços zebuínos parece estar ligada ao excesso de tecido adiposo interdigital. No caso do bovino deste estudo não há dados quanto à etiologia.
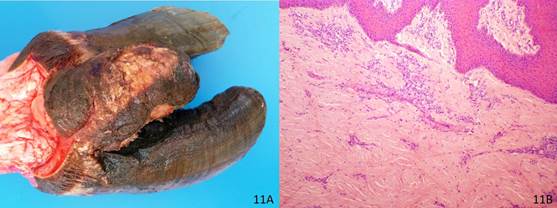
No exame macroscópico observou-se uma massa entre os dígitos dos membros pélvicos com 12x8x3 cm, recoberta por crostas (Fig.11A). Ao corte era dura e formada por feixes de um tecido brancacento. Microscopicamente, havia proliferação difusa de tecido conjuntivo fibroso bem diferenciado (Fig.11B).
Fibroma interdigital. (A) Observa-se uma massa 12x8x3 cm, recoberta por crostas entre os dígitos de um membro pélvico. (B). Histopatologia de A. A massa é constituída por uma proliferação difusa de tecido conjuntivo fibroso bem diferenciado. HE, obj.10x.
No diagnóstico diferencial devem ser consideradas outras doenças digitais de bovinos que possam culminar com lesões proliferativas no espaço interdigital (Borges & Pitombo 2007Borges J.R.J. & Pitombo C.A. 2007. Doenças digitais de etiologia incerta ou secundárias: pododermatite do paradígito, p.519-522. In: Riet-Correa F., Schild A.L., Lemos R.A.A.& Borges J.R.J. (Eds), Doenças de Ruminantes e Eqüídeos. vol. 2. 3ª ed. Pallotti, Santa Maria.).
Hemangiossarcoma
Hemangiossarcomas são neoplasmas malignos que se originam do endotélio vascular sanguíneo (Goldschmidt & Hendrick 2002Goldschmidt M.H. & Hendrick M.J. 2002. Tumors of skin and soft tissues, p.45-118. In: Meuten D.J. (Ed.), Tumours in Domestic Animals. 4th ed. Iowa State Press, Ames.); são comuns em cães, mas apenas ocasionais em bovinos (Dukes et al. 1982Dukes T.W., Bundza A. & Corner A.H. 1982. bovine neoplasms encountered in Canadian slaughterhouses: A summary. Can. Vet. J. 23:28-30.), podendo afetar vários órgãos.
No caso deste estudo fragmentos de fígado, pulmão e baço foram encaminhados para análise. Macroscopicamente, o parênquima hepático estava marcadamente amarelo com áreas hemorrágicas multifocais. A cápsula hepática estava espessada, com áreas mineralizadas. Na pleura pulmonar havia áreas circulares de hemorragia com mineralização central. No baço havia nódulos vermelhos e friáveis de diferentes tamanhos, bem delimitados e envoltos por cápsula fibrosa. Foi concluído que o sítio anatômico primário deveria ter sido o fígado. As proliferações no baço e pulmão foram consideradas metástases, mas não se pode afastar uma origem multicêntrica. Histologicamente, as células neoplásicas eram marcadamente pleomórficas, poligonais ou ovais e, usualmente, formavam fendas ou canais vasculares. Outras lesões a serem consideradas no diagnóstico diferencial incluem fibrossarcomas, sarcomas pouco diferenciados (Goldschmidt & Hendrick 2002Goldschmidt M.H. & Hendrick M.J. 2002. Tumors of skin and soft tissues, p.45-118. In: Meuten D.J. (Ed.), Tumours in Domestic Animals. 4th ed. Iowa State Press, Ames.), hamartomas vasculares e telangiectasia.
Lipossarcoma
Há poucos relatos da variante maligna dos lipomas (lipossarcomas) em bovinos, os quais têm a origem considerada como espontânea (Goldschmidt & Hendrick 2002Goldschmidt M.H. & Hendrick M.J. 2002. Tumors of skin and soft tissues, p.45-118. In: Meuten D.J. (Ed.), Tumours in Domestic Animals. 4th ed. Iowa State Press, Ames.). Sua aparência macroscópica varia conforme a quantidade de lipídeos produzidos pelas célula neoplásicas. Alguns mimetizam lipomas, enquanto outros, como o caso observado nesse bovino, são firmes, branco-acinzentados e infiltram os tecidos adjacentes (Goldschmidt & Hendrick 2002Goldschmidt M.H. & Hendrick M.J. 2002. Tumors of skin and soft tissues, p.45-118. In: Meuten D.J. (Ed.), Tumours in Domestic Animals. 4th ed. Iowa State Press, Ames.). Neste caso, a massa media cerca de 20x15x5 cm e estava aderida a uma das costelas, causando destruição óssea. Multifocalmente havia múltiplos fragmentos ósseos e áreas de hemorragia (Fig.12A). Microscopicamente, era caracterizado por uma proliferação de células redondas a fusiformes, arranjadas em ilhas ou feixes, que apresentavam vacúolos citoplasmáticos de diferentes tamanhos e núcleos pleomórficos comprimidos na periferia celular (Fig.12B). A classificação mais apropriada neste caso é de lipossarcoma pleomórfico (Goldschmidt & Hendrick 2002Goldschmidt M.H. & Hendrick M.J. 2002. Tumors of skin and soft tissues, p.45-118. In: Meuten D.J. (Ed.), Tumours in Domestic Animals. 4th ed. Iowa State Press, Ames.) uma vez que havia predominância de células altamente pleomórficas, associadas à presença de vacúolos intracitoplasmáticos. As células neoplásicas estavam sustentadas por um estroma fibroso e entre elas frequentemente se observavam lipócitos normais e áreas multifocais de necrose e hemorragia.
Lipossarcoma. (A) Massa na cavidade pleural fixada em uma das costelas, medindo cerca de 20x15x5 cm, amarela, com áreas de hemorragia e com múltiplos cistos. Ao corte possui fragmentos ósseos. (B) Histopatologia de A. Células redondas ou fusiformes proliferadas desorganizadamente ou arranjadas em ilhas ou feixes. As células apresentam vacúolos citoplasmáticos de diferentes tamanhos e núcleos pleomórficos comprimidos na periferia celular. HE, obj.20x.
Mesotelioma
Mesoteliomas são tumores do mesotélio, um tipo especial de células epiteliais que revestem as membranas serosas (Carter et al. 2007Carter D., True L. & Otis C.N. 2007. Serous membranes, p.547-562. In: Mills S.E. (Ed.), Histology for Pathologists. 3rd ed. Lippincott Williams & Wilkins, Philadelphia.). Mesoteliomas são neoplasmas raros. Em bovinos, ocorrem mais frequentemente como um neoplasma congênito no feto ou em terneiros (Uzal et al. 2016Uzal F.A., Plattner B.L. & Hostetter J.M. 2016 Alimentary system, p.1-257. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.2. 6th ed. Elsevier, St. Louis.). São frequentemente múltiplos e podem envolver as superfícies serosas, parietal e visceral, das cavidades pleural, pericárdica ou peritoneal (Carter et al. 2007Carter D., True L. & Otis C.N. 2007. Serous membranes, p.547-562. In: Mills S.E. (Ed.), Histology for Pathologists. 3rd ed. Lippincott Williams & Wilkins, Philadelphia.). Em bovinos, ocorrem mais frequentemente na cavidade abdominal do que no tórax (Uzal et al. 2016Uzal F.A., Plattner B.L. & Hostetter J.M. 2016 Alimentary system, p.1-257. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.2. 6th ed. Elsevier, St. Louis.). No caso encontrado em um bovino deste estudo foram observados múltiplos nódulos e placas coalescentes amarelas, que variavam entre 0,1 a 3 cm de diâmetro sobre o omento e peritônio. Muitas vezes as placas formavam pequenos agregados com 4x2x0,2 cm, macios ao corte. Microscopicamente, mesoteliomas podem ser epitelioides, ou sarcomatoides, ou mais comumente apresentar um padrão bifásico (Carter et al. 2007Carter D., True L. & Otis C.N. 2007. Serous membranes, p.547-562. In: Mills S.E. (Ed.), Histology for Pathologists. 3rd ed. Lippincott Williams & Wilkins, Philadelphia.). No caso deste estudo observaram-se células epiteliais proliferadas formando papilas, circundadas por abundante tecido conjunto fibroso e áreas de mineralização. As células epitelioides eram cúbicas ou colunares, com bordas distintas, citoplasma abundante e núcleo redondo a oval, com cromatina frouxa.
Macroscopicamente, mesoteliomas devem ser diferenciados de adenocarcinomas metastáticos, tuberculose, actinobacilose e outras infecções granulomatosas., como as causadas por actinobacilose e esofagostomose, ambas as lesões observadas previamente nesse estudo em outros bovinos abatidos. Embora muito semelhantes, essas três lesões possuem características que auxiliam na diferenciação. Na actinobacilose é comum a observação de pequenos pontos amarelos no centro da lesão, os quais quando pressionados deixam fluir pus (Tessele et al. 2014Tessele B., Martins T.B., Vielmo A. & Barros C.S.L. 2014. Lesões granulomatosas encontradas em bovinos abatidos para consumo. Pesq. Vet. Bras. 38:763-769.). A migração por larvas de Oesophagostomum sp. quando ocorre induz piogranulomas (Tessele et al. 2013Tessele B., Brum J.S. & Barros C.S.L. 2013. Lesões parasitárias encontradas em bovinos abatidos para consumo humano. Pesq. Vet. Bras. 33:873-889.).
Tumor estromal gastrointestinal
A expressão "tumor estromal gastrointestinal" (GIST) tem sido usada para descrever um grupo específico de tumores mesenquimais não linfoides que possui origem na parede do trato gastrointestinal de humanos e no trato gastrointestinal de cães, macacos e cavalos. Não há relatos na literatura em ruminantes (Cooper & Valentine 2002Cooper B.J. & Valentine B.A. 2002. Tumors of muscle, p.319-363. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames.).
GISTs não são distinguidos dos tumores de músculo liso em colorações de rotina como a hematoxilina e eosina. É proposto que os GISTs possuem origem das células intersticiais (miofibroblastos) de Cajal (Cooper & Valentine 2002Cooper B.J. & Valentine B.A. 2002. Tumors of muscle, p.319-363. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames., Uzal et al. 2016Uzal F.A., Plattner B.L. & Hostetter J.M. 2016 Alimentary system, p.1-257. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.2. 6th ed. Elsevier, St. Louis.). Células intersticiais de Cajal são encontradas no trato gastrointestinal e são parte do sistema de marca-passo cardíaco na parede intestinal. Essas células são positivas para CD117 na imuno-histoquímica, enquanto as células musculares lisas são negativas.
GISTs podem afetar ceco, duodeno, estômago e mesentério. No caso deste estudo, uma massa de, aproximadamente, 15x10x5 cm, multilobulada, circundava a parede do intestino delgado e obstruía parte do lúmen intestinal (Fig.13A,B). Metástases não foram encontradas.
Tumor estromal gastrointestinal em um bovino. (A) Há uma massa de, aproximadamente, 15x10x5 cm, multilobulada, circundando a parede do intestino delgado (um corte transversal da luz do intestino é visto na porção inferior esquerda da foto) e obstruindo parte do lúmen intestinal. (B) Corte longitudinal da massa tumoral mostrando a superfície de corte brancacenta com estrias amarelas. (C) Histopatologia de A-B. Células fusiformes ou ovoides proliferadas, altamente pleomórficas, formando feixes que se entrelaçam em diferentes direções. HE, obj.10x. (D) Imuno-histoquímica de A-B. Forte marcação positiva das células intersticiais de Cajal para c-kit (CD117). Células intersticiais de Cajal são encontradas no trato gastrointestinal e são parte do sistema de marca-passo cardíaco na parede intestinal. Essas células são positivas para CD117 na imuno-histoquímica, enquanto as células musculares lisas são negativas. IHQ, obj.10x.
GISTs podem ser divididos em quatro padrões morfológicos básicos, que podem ser vistos tanto em humanos quanto em animais: (1) padrão estoriforme, caracterizado por células fusiformes em um padrão mais ou menos estoriforme conforme o grau de diferenciação celular; (2) padrão mixoide, caracterizado por células alongadas a poligonais proliferadas de forma escassa em uma matriz mixoide; (3) padrão fascicular, em que células fusiformes entrelaçam-se em feixes. Esses tumores são altamente vasculares, com áreas extensas de hemorragia e necrose. (4) E padrão epitelioide, que é caracterizado por ilhas de células redondas a poligonais, separadas por um estroma escasso (Head et al. 2003Head K.W., Cullen J.M., Dubielzig R.R., Else R.W., Misdorp W., Patnaik A.K., Tateyama S. & Van der Gaag I. 2003. Histological classification of tumors of the alimentary system of domestic animals World Health Organization International vol. 10. Series Editor, Washington.). As células neoplásicas do tumor do bovino deste estudo apresentaram-se como células fusiformes a ovoides, altamente pleomórficas, formando feixes que se entrelaçavam em diferentes direções, como em um padrão estoriforme (Fig.13C).
GISTs devem ser diferenciados de tumores originários do músculo liso (leiomioma e leiomiossarcoma). A técnica de imuno-histoquímica (IHQ) é necessária para essa distinção. No presente caso houve forte marcação positiva para c-kit (CD117) (Fig.13D) - as células intersticiais de Cajal são reativas para esse anticorpo enquanto as células musculares lisas não (Frost et al. 2003Frost D., Lasota J. & Miettinen M. 2003. Gastrointestinal stromal tumors and leiomyomas in the dog: A histopathologic, immunohistochemical, and molecular genetic study of 50 sases. Vet. Pathol. 40:42-54.) - o que confirma nosso diagnóstico. Expressão de actina pode ocorrer em alguns GISTs que possuem diferenciação para músculo liso, enquanto que a reação para desmina é negativa. No caso aqui relatado, houve marcação positiva para actina de músculo liso e actina muscular, mas não para desmina.
Macroscopicamente esses tumores podem ser confundidos com linfoma intestinal, como ocorreu nesse caso, devido à aparência firme, branco-amarelada homogênea e discretamente lobulada que os linfomas apresentam (Barros 2007Barros C.S.L. 2007. Doenças víricas: leucose bovina, p.159-169. In: Riet- Correa F., Schild A.L., Lemos R.A.A. & Borges J.R.J. (Eds), Doenças de Ruminantes e Eqüídeos. vol. 1. 3ª ed. Pallotti, Santa Maria.).
Tumores melanocíticos
Tumores melanocíticos são neoplasmas de melanócitos originários da crista neural (Mauldin & Peters-Kennedy 2016Mauldin E.A. & Peters-Kennedy J. 2016. Integumentary system, p.509-736. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.). Podem ser divididos em lentigo (lentigo simplex), melanocitoma (melanoma benigno, nevo melanocítico), melanocitoma de células balonosas, melanocitoma-acantoma (melanoacantoma) e melanoma maligno (Mauldin & Peters-Kennedy 2016Mauldin E.A. & Peters-Kennedy J. 2016. Integumentary system, p.509-736. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.). Em bovinos, representam, aproximadamente, 6% de todos os tumores, ocorrendo mais comumente na pele e tecido subcutâneo, tendo uma maior tendência a serem benignos (Crowell et al. 1973Crowell W.A., Chandler E.W. & Williams D.J. 1973. Melanoma in cattle: fine structure and report of two cases. Am. J. Vet. Res. 34:1591-1593., Miller et al. 1995Miller M.A., Weaver A.D., Stogsdill J.R., Fischer J.M., Kreeger S.L. & Turk J.R. 1995. Cutaneous melanocytomas in 10 young cattle. Vet. Pathol. 32:479-484.).
A etiopatogênese dos tumores melanocíticos em bovinos, em grande parte, é desconhecida. Em bovinos, os tumores melanocíticos podem invadir o tecido subcutâneo e são, com frequência, marcadamente pigmentados, o que facilita o diagnóstico. Neoplasmas melanocíticos amelanóticos não foram relatados em bovinos. No bovino desse estudo havia uma massa de 9,5x7,5x7,5 cm na pele da região mamária, firme ao corte e com a superfície de corte lisa e preta (Fig.14A). Cortes do neoplasma deste caso, foram descorados com peróxido de hidrogênio a 10% durante 10 dias, para visualização das células tumorais e possibilitando o diagnóstico da variante benigna (melanocitoma) do neoplasma (Fig.14B).
Tumor melanocítico em um bovino. (A) Nódulo no tegumento da região mamária. Massa de 9,5x7,5x7,5 cm firme ao corte e com a superfície de corte lisa e preta. (B) Histopatologia de A. Observam-se células redondas ou fusiformes proliferadas formando um manto na derme superficial e profunda. Lâmina tratada com peróxido de hidrogênio durante 10 dias para retirada da melanina. HE, obj.20x.
Embora a pigmentação de tumores melanocíticos facilite o diagnóstico, outros neoplasmas cutâneos, como sarcoma melânico, podem apresentar aparência semelhante, assim como a melanose cutânea (Infante Gil 2000Infante Gil J. 2000. Manual de Inspeção Sanitária de Carnes. 2ª ed. Vol. 2. Fundação Calouste Gulbenkian, Lisboa.).
Referências
- Anderson L.J. & Sandison A.T. 1967. Tumors of the liver in cattle, sheep, and pigs. Cancer 21:289-301.
- Barros C.S.L. 2007. Doenças víricas: leucose bovina, p.159-169. In: Riet- Correa F., Schild A.L., Lemos R.A.A. & Borges J.R.J. (Eds), Doenças de Ruminantes e Eqüídeos. vol. 1. 3ª ed. Pallotti, Santa Maria.
- Barros C.S.L., Barros S.S., Santos M.N. & Abaid F. 1978. Adenocarcinoma de útero em bovino. Rev. Cento de Ciência Rurais. 8:277-281.
- Borges J.R.J. & Pitombo C.A. 2007. Doenças digitais de etiologia incerta ou secundárias: pododermatite do paradígito, p.519-522. In: Riet-Correa F., Schild A.L., Lemos R.A.A.& Borges J.R.J. (Eds), Doenças de Ruminantes e Eqüídeos. vol. 2. 3ª ed. Pallotti, Santa Maria.
- Brandly P.J. & Migaki G.1963. Types of tumors found by federal meat inspectors in an eight year survey. Ann. N. Y. Acad. Sci. 108:1872-1879.
- Cantile C. & Youssef S. 2016. Nervous system, p.250-406. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. Vol.2. 6th ed. Elsevier, St. Louis.
- Carter D., True L. & Otis C.N. 2007. Serous membranes, p.547-562. In: Mills S.E. (Ed.), Histology for Pathologists. 3rd ed. Lippincott Williams & Wilkins, Philadelphia.
- Caswell J.L. & Williams K.J. 2016. Respiratory system, p.465-591. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.
- Cianciolo R. & Mohr F.C. 2016. Urinary system, p.376-464. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. Vol.2. 6th ed. Elsevier, St. Louis.
- Cooper B.J. & Valentine B.A. 2002. Tumors of muscle, p.319-363. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames.
- Crowell W.A., Chandler E.W. & Williams D.J. 1973. Melanoma in cattle: fine structure and report of two cases. Am. J. Vet. Res. 34:1591-1593.
- Cruz C.E.F., Driemeier D., Cerva C. & Corbellini L.G. 2001. Clinical and epidemiological aspects of bovine digital lesions in southern Brazil. Arq. Bras. Med. Vet. Zootec. 53:654-657.
- Cullen J.M. & Popp J.A. 2002. Tumors of the liver and gall bladder, p.483-508. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames .
- Dukes T.W., Bundza A. & Corner A.H. 1982. bovine neoplasms encountered in Canadian slaughterhouses: A summary. Can. Vet. J. 23:28-30.
- Fighera R.A. & Barros C.S.L. 2004. Linfossarcoma intracerebral em bovino. Ciência Rural 34:943-945.
- Ford T.S., Ross M.W., Acland H.M. & Madison J.B. 1989. Primary teat neoplasia in two yearling heifers. J. Am. Vet. Med. Assoc. 195:238-239.
- Frost D., Lasota J. & Miettinen M. 2003. Gastrointestinal stromal tumors and leiomyomas in the dog: A histopathologic, immunohistochemical, and molecular genetic study of 50 sases. Vet. Pathol. 40:42-54.
- Gava A., Neves D.S., Gava D., Moura T.S., Schild A.L.& Riet-Correa F. 2002. Bracken fern (Pteridium aquilinum) poisoning in cattle in Southern Brazil. Vet. Human Toxicol. 44:362-365.
- Goldschmidt M.H. & Hendrick M.J. 2002. Tumors of skin and soft tissues, p.45-118. In: Meuten D.J. (Ed.), Tumours in Domestic Animals. 4th ed. Iowa State Press, Ames.
- Gopal T. & Leipold H.W. 1979. Lipomeningocele in a calf. Vet. Pathol. 16:610-612.
- Grist A. 2008. Bovine Meat Inspection: Anatomy, Physiology and Disease Conditions. 2nd ed. Nottingham University Press, Nottingham.
- Head K.W., Cullen J.M., Dubielzig R.R., Else R.W., Misdorp W., Patnaik A.K., Tateyama S. & Van der Gaag I. 2003. Histological classification of tumors of the alimentary system of domestic animals World Health Organization International vol. 10. Series Editor, Washington.
- Infante Gil J. 2000. Manual de Inspeção Sanitária de Carnes. 2ª ed. Vol. 2. Fundação Calouste Gulbenkian, Lisboa.
- Kelley L.C., Crowell W.A., Puette M., Langheinrich K.A. & Self A.D. 1996. A retrospective study of multicentric bovine renal cell tumors. Vet. Pathol. 33:133-141.
- Kenneth M. & Svend W.N. 1976. Tumours of the female genital tract. Bull World Health Organ. 53:217-226.
- Kenny J.E. 1944. Some observations on bovine neoplasia. Vet. Rec. 56:69-71.
- Lester S.C. 2015. The breast, p.1343-1070. In: Kumar V., Abbas A.K. & Aster J.C. Robbins and Cotran Pathological Basis of Disease, 9th ed. Elsevier Saunders, Philadelphia.
- Maclachlan N.J. & Kennedy P.C. 2002. Tumors of the genital systems, p.547-573. In: Meuten D.J. (Ed.), Tumors in Domestic Animals. 4th Iowa State Press, Ames.
- Mauldin E.A. & Peters-Kennedy J. 2016. Integumentary system, p.509-736. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.
- Max D.T. 2007.The Family That Couldn't Sleep: A Medical Mystery, p.167. Random House, New York.
- Maxie M.G. & Miller M.A. 2016. Introduction to the diagnostic process, p.1-15. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. Vol. 1. 6th ed. Elsevier, St. Louis.
- Miller M.A., Weaver A.D., Stogsdill J.R., Fischer J.M., Kreeger S.L. & Turk J.R. 1995. Cutaneous melanocytomas in 10 young cattle. Vet. Pathol. 32:479-484.
- Ministério da Agricultura. 1980. Regulamento da Inspeção Industrial e Sanitária de Produtos de Origem Animal (R.I.I.S.P.O.A). Aprovado pelo decreto no. 30690 de 20.03.52, alterado pelo decreto nº 1255, de 25.06.52. Brasília. 66p.
- Pereira W.L.A., Silva A.W.C. & Pinto M.N. 2007. Feocromocitoma em bovinos de abate: relatos de casos. Arq. Bras. Med. Vet. Zootec. 59:301-305.
- Peterman S.B., Steiner R.E. & Bydder G.M. 1984. Magnetic resonance imaging of intracranial tumors in children and adoleseents. Amer. J. Neuroradiol. 5:703-709.
- Piercy D.W., Cranwell M.P. & Wonnacott B.J. 1993. Anaplastic small cell carcinoma of the lung in a six-month-old Friesian calf. Vet Rec. 132:386-387.
- Povey R.C. & Osborne A.D. 1969. Mammary gland neoplasia in the cow. A Review of the literature and report of a fibrosarcoma. Path. Vet. 6:502-512.
- Rosol T.J. & Gröne A. 2016. Endocrine glands, p.269-357. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.
- Sandison A.T. & Anderson L.J. 1968. Tumors of the kidney in cattle, sheep, and pigs. Cancer 21:727-742.
- Santos R.L., Nascimento E.F. & Edwards J. 2011. Sistema reprodutivo feminino, p.798-854. In: Santos R.L. & Alessi A.C. (Ed.), Patologia Veterinária. Roca, São Paulo.
- Schlafer D.H. & Foster R.A. 2016. Female genital system, p.258-464. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer´s Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.
- Stünzi H., Head K.W. & Nielsen S.W. 1974. Tumours of lungs. Bull. Wld. Hlth. Org. 50:9-19.
- Tessele B., Brum J.S. & Barros C.S.L. 2013. Lesões parasitárias encontradas em bovinos abatidos para consumo humano. Pesq. Vet. Bras. 33:873-889.
- Tessele B., Martins T.B., Vielmo A. & Barros C.S.L. 2014. Lesões granulomatosas encontradas em bovinos abatidos para consumo. Pesq. Vet. Bras. 38:763-769.
- Tessele B., Rissi D.R., Langohr I.M., Vielmo A. & Barros C.S.L. 2015. Mixed apocrine adenocarcinoma of the tail in a cow. Braz. J. Vet. Pathol. 8:72-75.
- Thibault S., Mikaelian I., Dubreuil P., Drolet R. & Couture Y. 1997. Mammary fibroadenoma in a heifer. Can Vet J. 38:785-786.
- United States Department of Agriculture. 1945. Yearbook, United States Department of Agriculture.
- Uzal F.A., Plattner B.L. & Hostetter J.M. 2016 Alimentary system, p.1-257. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.2. 6th ed. Elsevier, St. Louis.
- Valli V.E.O., Kiupel M. & Benzle G.J.M. 2016. Hematopoietic system, p.102-268. In: Maxie M.G. (Ed.), Jubb, Kennedy, and Palmer's Pathology of Domestic Animals. vol.3. 6th ed. Elsevier, St. Louis.
- Wright B.J. & Conner G.H. 1968. Adrenal neoplasms in slaughtered cattle. Cancer Res. 28:251-263.
- Zettner A. & Netsky M. 1960. Lipoma of the corpus callosum. J. Neuropathol. Exper. Neurol. 19:305-319.
-
1
Parte da Tese de Doutorado do primeiro autor
Datas de Publicação
-
Publicação nesta coleção
Mar 2016
Histórico
-
Recebido
07 Nov 2015 -
Aceito
26 Dez 2015