Resumos
OBJETIVO: Este artigo revisa o sistema endocanabinoide e as respectivas estratégias de intervenções farmacológicas. MÉTODO: Realizou-se uma revisão da literatura sobre o sistema endocanabinoide e a sua farmacologia, considerando-se artigos originais ou de revisão escritos em inglês. DISCUSSÃO: Canabinoides são um grupo de compostos presentes na Cannabis Sativa (maconha), a exemplo do Δ9-tetraidrocanabinol e seus análogos sintéticos. Estudos sobre o seu perfil farmacológico levaram à descoberta do sistema endocanabinoide do cérebro de mamíferos. Este sistema é composto por pelo menos dois receptores acoplados a uma proteína G, CB1 e CB2, pelos seus ligantes endógenos (endocanabinoides; a exemplo da anandamida e do 2-araquidonoil glicerol) e pelas enzimas responsáveis por sintetizá-los e metabolizá-los. Os endocanabinoides representam uma classe de mensageiros neurais que são sintetizados sob demanda e liberados de neurônios pós-sinápticos para restringir a liberação de neurotransmissores clássicos de terminais pré-sinápticos. Esta sinalização retrógrada modula uma diversidade de funções cerebrais, incluindo ansiedade, medo e humor, em que a ativação de receptores CB1 pode exercer efeitos dos tipos ansiolítico e antidepressivo em estudos préclínicos. CONCLUSÃO: Experimentos com modelos animais sugerem que drogas que facilitam a ação dos endocanabinoides podem representar uma nova estratégia para o tratamento de transtornos de ansiedade e depressão.
Cannabis sativa; Canabinoides; Endocanabinoides; Ansiedade; Depressão
OBJECTIVE: The present review provides a brief introduction into the endocannabinoid system and discusses main strategies of pharmacological interventions. METHOD: We have reviewed the literature relating to the endocannabinoid system and its pharmacology; both original and review articles written in English were considered. DISCUSSION: Cannabinoids are a group of compounds present in Cannabis Sativa (hemp), such as Δ9-tetrahydrocannabinol, and their synthetic analogues. Research on their pharmacological profile led to the discovery of the endocannabinoid system in the mammalian brain. This system comprises at least two G-protein coupled receptors, CB1 and CB2, their endogenous ligands (endocannabinoids; e.g. the fatty acid derivatives anandamide and 2-arachydonoyl glycerol), and the enzymes responsible for endocannabinoid synthesis and catabolism. Endocannabinoids represent a class of neuromessengers, which are synthesized on demand and released from post-synaptic neurons to restrain the release of classical neurotransmitters from pre-synaptic terminals.This retrograde signalling modulates a variety of brain functions, including anxiety, fear and mood, whereby activation of CB1 receptors was shown to exert anxiolytic-and antidepressant-like effects in preclinical studies. CONCLUSION: Animal experiments suggest that drugs promoting endocannabinoid action may represent a novel strategy for the treatment of depression and anxiety disorders.
Cannabis sativa; Cannabinoids; Endocannabinoides; Anxiety; Depression
ARTIGOS ORIGINAIS
Exploração farmacológica do sistema endocanabinoide: novas perspectivas para o tratamento de transtornos de ansiedade e depressão?
Viviane M. SaitoI; Carsten T. WotjakII; Fabrício A. MoreiraI,III
IPrograma de pós-graduação em Neurociências, Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil
IIMax Planck Institute of Psychiatry, Research Group Neuronal Plasticity, Munique, Alemanha
IIIDepartamento de Farmacologia, Instituto de Ciências Biológicas, Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil
Correspondência Correspondência: Fabrício A. Moreira Department of Pharmacology, Institute of Biological Sciences Universidade Federal de Minas Gerais (UFMG) Av. Antônio Carlos, 6627 31270-901 Belo Horizonte, MG, Brasil Tel.: (+55 31) 3409-2720 E-mail: fabriciomoreira@icb.ufmg.br
RESUMO
OBJETIVO: Este artigo revisa o sistema endocanabinoide e as respectivas estratégias de intervenções farmacológicas.
MÉTODO: Realizou-se uma revisão da literatura sobre o sistema endocanabinoide e a sua farmacologia, considerando-se artigos originais ou de revisão escritos em inglês.
DISCUSSÃO: Canabinoides são um grupo de compostos presentes na Cannabis Sativa (maconha), a exemplo do Δ9-tetraidrocanabinol e seus análogos sintéticos. Estudos sobre o seu perfil farmacológico levaram à descoberta do sistema endocanabinoide do cérebro de mamíferos. Este sistema é composto por pelo menos dois receptores acoplados a uma proteína G, CB1 e CB2, pelos seus ligantes endógenos (endocanabinoides; a exemplo da anandamida e do 2-araquidonoil glicerol) e pelas enzimas responsáveis por sintetizá-los e metabolizá-los. Os endocanabinoides representam uma classe de mensageiros neurais que são sintetizados sob demanda e liberados de neurônios pós-sinápticos para restringir a liberação de neurotransmissores clássicos de terminais pré-sinápticos. Esta sinalização retrógrada modula uma diversidade de funções cerebrais, incluindo ansiedade, medo e humor, em que a ativação de receptores CB1 pode exercer efeitos dos tipos ansiolítico e antidepressivo em estudos préclínicos.
CONCLUSÃO: Experimentos com modelos animais sugerem que drogas que facilitam a ação dos endocanabinoides podem representar uma nova estratégia para o tratamento de transtornos de ansiedade e depressão.
Descritores: Cannabis sativa; Canabinoides; Endocanabinoides; Ansiedade; Depressão
Introdução
Devido aos seus efeitos analgésicos, antieméticos e tranqui-medicinais por séculos. Além disso, as preparações da cannabis, lizantes, a erva Cannabis Sativa tem sido utilizada com propósitos tais como a marijuana, o haxixe ou o skunk, possuem um longo histórico como drogas de abuso1. Os efeitos típicos da cannabis são amnésia, sedação e sentimento de bem-estar descrito como "felicidade"2. Na metade do século passado, Raphael Mechoulam et al. identificaram o Δ9-tetraidrocanabinol (Δ9-THC) como o principal ingrediente psicoativo desta erva. Hoje em dia, sabese que a Cannabis Sativa contém mais de 60 substâncias, tais como canabidiol, canabinol e canabicromeno, denominados fitocanabinoides3. Sua natureza lipídica colocou um obstáculo significativo às experiências químicas, o que poderia explicar porque a descoberta dos fitocanabinoides ocorreu tardiamente em comparação com outros compostos naturais (e.g. a morfina foi isolada do ópio no século 19). A estrutura molecular sugeria como provável que o Δ9-THC exercesse seus efeitos primariamente por meio da alteração das características físico-químicas das membranas celulares. Portanto, foi uma surpresa que pudessem ser identificados sítios específicos de acoplamento no cérebro dos mamíferos4, seguidos por isolamento e caracterização das substâncias ligantes endógenas, denominadas endocanabinoides5. O desenvolvimento de novos compostos farmacológicos que tenham como alvo os receptores ou a síntese e a degradação dos ligantes revelou várias funções cerebrais complexas, que são estritamente controladas pelo sistema endocanabinoide. O objetivo desta revisão é o de introduzir brevemente esse sistema e sua farmacologia, discutir seu envolvimento na psicopatologia e ilustrar seu potencial terapêutico.
Método
Revisamos a literatura relativa ao sistema endocanabinoide e às possibilidades de intervenções farmacológicas nesse sistema. Foram considerados estudos que empregaram sujeitos humanos ou animais e artigos de revisão, todos escritos em inglês.
Discussão
1. O sistema endocanabinoide cerebral
O sistema endocanabinoide compreende os receptores, os agonistas endógenos e o aparato bioquímico relacionado responsável por sintetizar essas substâncias e finalizar suas ações. Os receptores foram nomeados pela União Internacional de Farmacologia Básica e Clínica (International Union of Basic and Clinical Pharmacology -IUPHAR), de acordo com sua ordem de descoberta, como receptores CB1 e CB26. Ambos são receptores acoplados à proteína G. Dentro dos sistemas nervosos centrais, o CB1 está primariamente localizado nos terminais nervosos pré-sinápticos e é responsável pela maioria dos efeitos neurocomportamentais dos canabinoides. O CB2, ao contrário, é o principal receptor de canabinoide no sistema imune, mas também pode expressar-se nos neurônios. Os principais agonistas endógenos de CB1 e CB2 são os derivados do ácido araquidônico. A etanolamina araquidonoil foi o primeiro endocanabinoide caracterizado e apelidado de anandamida, do sânscrito ananda, que significa "felicidade"5. Posteriormente, o glicerol 2-araquidonoil (2-AG) foi também identificado7, seguido pela dopamina N-araquidonoil (NADA), o éter glicerol 2-araquidonoil (noladina) e a etanolamina O-araquidonoil, também denominada virodamina8. Os endocanabinoides podem se acoplar a outros receptores além do CB1 e do CB2, por exemplo, ao receptor potencial transitório de vaniloide tipo-1 (TRPV1), anteriormente denominado "receptor de capsaicina" ou "receptor de vaniloide" (VR1), um canal iônico. No sistema nervoso periférico, o TRPV1 é ativado por calor, baixo pH e substância da pimenta malagueta, a capsaicina9. Dentro do sistema nervoso central, o TRPV1 é expresso nos terminais nervosos pós-sinápticos e é possível que seja ativado de forma intracelular pela anandamida. Outros receptores de endocanabinoide são o receptor 55 ligado à proteína G, anteriormente "órfão", e os receptores ativados pelo proliferador peroxisoma (PPAR). Além disso, foi identificado um sítio alostérico no receptor CB1, o que pode fornecer um alvo interessante para a intervenção farmacológica10.
2. Modos de ação dos endocanabinoides
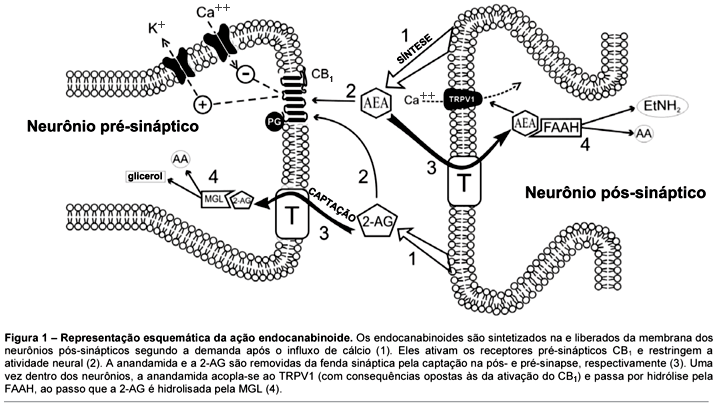
Os neurotransmissores clássicos, tais como a acetilcolina, os aminoácidos (e.g. glutamato, GABA) ou as monoaminas (e.g. dopamina, serotonina), preenchem os seguintes critérios: 1) os transmissores são sintetizados nos terminais pré-sinápticos a partir de precursores específicos e armazenados em vesículas sinápticas; 2) eles são liberados na fenda sináptica após um influxo de cálcio; 3) há mecanismos específicos para que finalizem suas ações, incluindo a captação e a degradação enzimática11,12. Estes critérios tornam os endocanabinoides mensageiros atípicos, que medeiam a transferência das informações dos terminais pós aos pré-sinápticos de uma forma retrógrada: os endocanabinoides são sintetizados sob demanda e não são armazenados em vesículas. As sínteses ocorrem nos neurônios pós-sinápticos após o influxo de cálcio e a subsequente ativação das fosfolipases (fosfolipase D no caso da anandamida e diaciglicerol lipase no caso da 2-AG), que convertem os fosfolipídeos em endocanabinoides13. Eles parecem atingir imediatamente a fenda sináptica por meio da difusão livre ou assistida e se acoplar aos receptores CB1 pré-sinápticos14. Por meio de uma rede complexa de processos de sinalização intracelular, a ativação dos receptores CB1 resulta finalmente em uma diminuição no influxo de cálcio nos terminais axônicos e, dessa forma, na diminuição da liberação do transmissor. Ademais da ativação do CB1, a ativação dos receptores TRPV1 pela anandamida leva à despolarização aumentada das membranas pós-sinápticas. Portando, a ativação do CB1 e do TRPV1 parece exercer efeitos opostos.
Assim como no caso dos neurotransmissores clássicos, as ações dos endocanabinoides são limitadas por um processo em duas etapas: internalização, seguida por catabolismo15 . A primeira etapa ainda não está clara, já que há debate sobre se a internalização dos endocanabinoides ocorre passivamente por meio da difusão ou por transportadores específicos16-19. Após a internalização, os endocanabinoides sofrem hidrólise enzimática. As principais enzimas responsáveis pela hidrólise da anandamida e da 2-AG são a amida hidrolase de ácidos graxos (FAAH)20 e a lipase monoacilglicerol (MGL)21, respectivamente. É intrigante que os dois endocanabinoides sejam degradados tanto de forma pré-sináptica (2-AG) como pós-sináptica (anandamida). Tanto a FAAH quanto a MGL emergiram como importantes alvos farmacológicos com potencial terapêutico promissor. A Figura 1 resume nosso conhecimento atual sobre os principais "atores" do sistema endocanabinoide.
3. Manipulação farmacológica do sistema endocanabinoide
Vários instrumentos farmacológicos foram desenvolvidos para interferir no sistema endocanabinoide. Alguns podem atuar diretamente nos receptores CB1 ou CB2 (i.e., agonistas ou antagonistas). Outros podem atuar de uma forma indireta, e.g. interferindo nos mecanismos que finalizam a ação endocanabinoide. A Tabela 1 lista os exemplos representativos de cada uma das estratégias de intervenção, que serão introduzidas nos parágrafos seguintes.
1) Agonistas de receptores de canabinoides
Baseados na estrutura química do Δ9-THC, vários agonistas sintéticos foram desenvolvidos com diversas atividades e afinidades intrínsecas para os receptores de canabinoides6,22. Nesse contexto, o rato tétrade surgiu como um instrumento valioso para a caracterização dos agonistas do receptor CB1. A denominação tétrade remete-se aos quatro efeitos principais do tratamento sistêmico com canabinoide: hipolocomoção, catalepsia, hipotermia e analgesia23,24. Estudos em ratos nocaute condicional com deleção celular específica ao tipo de CB1 revelaram que os efeitos tétrade são mediados por diferentes populações neuronais25.
Alguns agonistas apresentam a mesma afinidade pelos receptores CB1 e CB2, tais como o Δ9-THC, a nabilona, o WIN-55,212-2, o CP-55940 ou o HU-210. Outros se acoplam de forma especialmente seletiva ao CB1 (e.g. ACEA) ou CB2, (e.g. AM-1241, JWH-133). Além disso, foram desenvolvidos compostos que atuam no sítio alostérico do CB1 (e.g. Org275796, Org29647 e PSNCBAM)10. Ademais do Δ9-THC, outros fitocanabinoides com baixa afinidade pelo receptor CB1 (e.g. canabidiol) podem atuar por meio de mecanismos complexos, com alvo nos receptores não relacionados ao sistema endocanabinoide26-28.
2) Potencialização da ação endocanabinoide
As drogas que ampliam a ação endocanabinoide podem fornecer uma estratégia mais sutil para as intervenções farmacológicas do que a ativação direta dos receptores canabinoides. Dado que os endocanabinoides são produzidos e liberados sob demanda, os compostos que interferem na captação e degradação de endocanabinoides podem aumentar a sinalização de CB1 com especificidade temporal e neuroanatômica. Espera-se que essas drogas induzam menos efeitos colaterais em comparação aos agonistas diretos, como será discutido mais adiante. Várias drogas que aparentemente aumentam a ação endocanabinoide por meio do bloqueio da captação de endocanabinoide foram desenvolvidas17,29. Exemplos delas são o AM404, o VDM11, o UCM707, o OMDM e o AM1172. As desvantagens desses compostos são que pode lhes faltar seletividade farmacológica, além de terem como alvo o transportador de endocanabinoide, uma entidade bioquímica ainda pouco definida.
Outra estratégia para aumentar a sinalização dos endocanabinoides é a de inibir os processos catabólicos. Esse enfoque parece ser o mais promissor, já que as enzimas responsáveis pela hidrólise endocanabinoide estão bem caracterizadas. Entre os inibidores da FAAH, o URB-597 foi o mais amplamente estudado até agora30,31. Esse composto bloqueia irreversivelmente a FAAH com boa seletividade de alvo, levando a maiores níveis de anandamida. Mais recentemente, os inibidores de MGL foram também desenvolvidos (e.g. URB602 ou JZL184), causando maior biodisponibilidade de 2-AG32,33. A inibição da hidrólise de 2-AG, mas não a de anandamida, exerce efeitos tétrade similares aos agonistas de CB133. Isso ressalta a dissociação funcional entre a ação da 2-AG e da anandamida.
3) Inibição da ação endocanabinoide
Vários antagonistas com diferentes afinidades por receptores CB1 e CB2 foram sintetizados. O primeiro composto e protótipo, que se acopla ao receptor CB1 e bloqueia os efeitos de seus ligantes endógenos, é o SR141716A (SR1; rimonabanto)34. Outro antagonista de CB1 amplamente empregado é o AM256,22. Os receptores CB2, por seu lado, podem ser bloqueados de uma forma seletiva pelo SR1414528 e pelo AM6306,22.
Uma estratégia alternativa para reduzir a sinalização de endocanabinoides seria a inibição das enzimas anabólicas. Até agora, esta estratégia não foi amplamente explorada, possivelmente devido à diversidade de mecanismos responsáveis pela síntese de anandamida e de 2-AG. Os primeiros compostos que podem inibir a síntese de 2-AG são o O-3640 e o O-384135.
4. Papel do sistema endocanabinoide nos transtornos psiquiátricos
O rimonabanto foi o primeiro composto farmacológico que interferia no sistema endocanabinoide a ser aprovado para o tratamento da síndrome metabólica. Hoje sabemos que a droga exerce seus efeitos benéficos principalmente pelo bloqueio dos receptores CB1 na periferia. No entanto, devido à sua natureza lipofílica, o rimonabanto podia cruzar a barreira hemato-encefálica e ingressar no sistema nervoso central, onde tinha efeitos devastadores em pacientes, tais como aumento de depressão, suicidalidade e transtornos de ansiedade36. Após ser rejeitado pela FDA, o rimonabanto (também conhecido como AccompliaTM) foi retirado do mercado pela Sanofi-Aventis. A saga do rimonabanto ilustra como os clínicos aprenderam de forma "acidental" que a pletora de efeitos ansiogênicos descritos para o composto em modelos animais também se aplicava aos seres humanos. Eles poderiam ter sido "advertidos" antes pelos efeitos dramáticos do abuso de cannabis na regulação dos estados emocionais: o consumo de cannabis pode induzir efeitos ansiolíticos, eufóricos e recompensadores, além de melhorar o humor2. No entanto, após o consumo de cannabis, foram frequentemente encontrados sintomas psicóticos, ataques de pânico e distúrbios do humor2.
Estudos em modelos animais forneceram evidências mais diretas sobre o envolvimento do sistema endocanabinoide na ansiedade e na depressão. Eles revelaram que o sistema endocanabinoide é funcional em várias regiões cerebrais, tais como o córtex pré-frontal, o hipocampo, a amígdala e a substância cinzenta periaquedutal mesocerebral37, que estão envolvidos em diversos transtornos psiquiátricos. Sobretudo, ratos mutantes que não possuem expressão de receptores CB1 exibem uma pletora de alterações comportamentais que se assemelha à psicopatologia relacionada ao estresse38 . Por exemplo, eles apresentam um fenótipo similar à ansiedade em testes baseados na exploração39,40, nas respostas prolongadas ao medo41, no prejuízo para lidar como estresse40,42 e na extinção prejudicada de memórias aversivas43, mas não de memórias apetitivas44. O tratamento de ratos selvagens com antagonistas de receptor CB1 revelou essencialmente os mesmos fenótipos.
As alterações nos níveis de endocanabinoides estiveram de acordo com os dados comportamentais. Por exemplo, vários estressores causaram um aumento nos níveis de endocanabinoides na amígdala43 ou substância cinzenta periaquedutal32 . Ao mesmo tempo, eles os reduziram em outras estruturas como o hipocampo45. A regulação divergente da síntese da anandamida vs. 2-AG e das alterações tônicas vs. fásicas ilustram a complexidade desses processos. As alterações da sinalização endocanabinoide no hipotálamo46 podem contribuir para as consequências modulatórias do sistema endocanabinoide na regulação das respostas hormonais ao estresse47.
Poucos estudos mediram os níveis de endocanabinoides em transtornos psiquiátricos até hoje: as concentrações séricas basais de AEA e de 2-AG estavam significativamente reduzidas em mulheres com depressão maior48, o que sugere um papel deste sistema neste transtorno. Além disso, os pacientes com esquizofrenia apresentaram níveis aumentados de anandamida no líquido cérebro-raquidiano49. No entanto, devido à complexidade da sinalização endocanabinoide intracelular mencionada antes, as medidas de endocanabinoides em amostras sanguíneas e até do líquor poderiam ser de valor limitado para a nossa compreensão sobre o envolvimento do sistema endocanabinoide nos distúrbios de humor.
De conjunto, com poucas exceções50,51, a maioria dos dados préclínicos e clínicos dão suporte a um cenário em que a sinalização atenuada de endocanabinoides promove a ocorrência de sintomas semelhantes aos da ansiedade e da depressão.
5. Perspectivas farmacológicas e terapêuticas
As diversas substâncias que interferem no sistema endocanabinoide e na sinalização do CB1 foram extensamente estudadas em animais em termos da eficácia e dos efeitos colaterais na regulação do humor e da ansiedade. Os próximos parágrafos discutem as vantagens e limitações de cada uma das estratégias de tratamento (ver o resumo na Tabela 1).
1) Agonistas de receptores de canabinoides
Doses baixas de Δ9-THC e seus análogos sintéticos exercem efeitos de tipo assemelhado aos ansiolíticos em modelos animais do transtorno de ansiedade generalizada52. Ademais, os canabinoides prejudicaram a formação do medo contextual, mas facilitaram a sua extinção53,54. Além das atividades assemelhadas às ansiolíticas, os canabinoides demonstraram propriedades assemelhadas às dos antidepressivos. No nível comportamental, eles aliviaram as consequências dos estressores inevitáveis em modelos animais da depressão55,56. Além disso, os canabinoides aumentaram os níveis de neurotrofinas, induziram a neurogênese hipocampal e suprimiram a secreção do hormônio do estresse38,42,48.
Ainda que se possam vislumbrar aplicações terapêuticas para essas substâncias, há grandes obstáculos que limitam sua aplicabilidade na prática clínica. Por exemplo, o tratamento com canabinoides pode causar adição e tolerância, induzir efeitos sedativos e prejudicar o aprendizado e a memória. Em geral, doses baixas tendem a induzir ansiólise, ao passo que doses mais altas podem induzir efeitos opostos57,58. As razões para essas diferenças ainda estão por ser determinadas. Elas poderiam ser atribuídas às ações dependentes da dose em diferentes regiões cerebrais e populações neurais58. Ademais, altas concentrações de canabinoides podem levar à dessensibilização/internalização de receptores CB1, resultando assim em menor sinalização de endocanabinoides. É tentador supor que tais processos são responsáveis pelos efeitos paradoxais do consumo de cannabis nas respostas emocionais como episódios de ansiedade e pânico2. Para contornar esses problemas, estudos futuros podem tentar ter como alvo o sítio alostérico do receptor CB110.
2) Compostos que potencializam a ação endocanabinoide
A principal diferença entre as ações exógena e endógena dos canabinoides é a ativação por demanda do sistema endocanabinoide de uma forma temporal e espacialmente restrita. As drogas que ampliam a ação endocanabinoide foram extensamente estudadas em modelos animais de ansiedade e depressão. Por exemplo, o bloqueio da captação de endocanabinoides pelo AM404 induziu os efeitos similares aos dos ansiolíticos59,60 e facilitou a extinção do medo condionado61,62. O tratamento com o inibidor da hidrólise da anandamida URB597 também exerceu efeitos assemelhados aos dos ansiolíticos similares aos dos benzodiazepínicos30,60,63-65. O URB597 apresentou também ações assemelhadas às dos antidepressivos em modelos animais da psicopatologia relacionada ao estresse66,67. É notável que o URB597 tenha aumentado a atividade dos neurônios monoaminérgicos que se projetam do mesencéfalo para o córtex pré-frontal, um efeito similar aos observados após o tratamento crônico com drogas antidepressivas67 .
Deve-se destacar que alguns compostos farmacológicos bem estabelecidos, tais como a aspirina ou o paracetamol, dependem para sua ação, pelo menos parcialmente, da sinalização de endocanabinoides68 . Isso pode contribuir para seus efeitos animadores do humor69.
Em resumo, a captação e/ou hidrólise da anandamida representa alvos farmacológicos promissores para o desenvolvimento de novas estratégias terapêuticas da depressão e dos transtornos de ansiedade. Os efeitos induzidos por esses "potencializadores de endocanabinoides" diferem daqueles dos agonistas diretos de CB1 em vários aspectos: primeiro, eles evitam a ativação ubíqua do receptor, mas promovem a ação endocanabinoide de uma forma temporal e espacial restrita. Segundo, eles apresentam uma janela terapêutica mais ampla. Terceiro, estudos pré-clínicos apontam para um risco significativamente menor de adição, de susceptibilidade ao abuso e tolerância. Quarto, a ocorrência de efeitos paradoxais bifásicos nas respostas emocionais foi menos evidente.
A aplicabilidade dos "potencializadores de endocanabinoides" está limitada pelas capacidades promíscuas de acoplamento da anandamida, por exemplo, o acoplamento ao TRPV1 parece exercer efeitos opostos àqueles mediados via CB157,70. Assim, o bloqueio simultâneo de FAAH e TRPV1 pode representar um enfoque razoável para obter drogas ansiolíticas e/ou antidepressivas mais eficazes. De fato, o composto araquidonoil serotonina (AA5HT), que preenche esses objetivos, induziu efeitos similares aos dos ansiolíticos em ratos com maior eficácia do que o URB59764.
3) Antagonistas de receptores de canabinoides
O desenvolvimento de novas gerações de antagonistas de receptores CB1 com acesso restrito ao cérebro pode possibilitar a exploração dos efeitos benéficos do bloqueio da sinalização de endocanabinoides em tecidos periféricos (e.g. hepatócitos ou adipócitos) no diabetes ou na síndrome metabólica, sem os efeitos colaterais devastadores no humor e na cognição36.
Conclusão
O mau funcionamento do sistema endocanabinoide pode promover o desenvolvimento e a manutenção de transtornos psiquiátricos como a depressão, as fobias e o transtorno de pânico. Assim, espera-se que os agonistas de CB1 ou os inibidores da hidrólise de anandamida exerçam efeitos antidepressivos e ansiolíticos. Estudos futuros devem considerar 1) o desenvolvimento de antagonistas de CB1 que não possam ultrapassar facilmente a barreira hemato-encefálica; 2) alterações no equilíbrio da sinalização de CB1 vs. TRPV1; 3) o sítio alostérico do receptor CB1; e 4) o envolvimento potencial do receptor CB2 na regulação do humor. Similaridades notáveis na ação (endo) canabinoide em animais e seres humanos torna provável que os novos princípios farmacológicos delineados neste artigo possam encontrar seu caminho na prática clínica.
Agradecimentos
F.A.M. recebe uma bolsa de pesquisa da Fundação de Apoio à Pesquisa do Estado de Minas Gerais (FAPEMIG). C.T.W. recebe apoio financeiro da Max Planck Society.
- 1. Zuardi AW. History of cannabis as a medicine: a review. Rev Bras Psiquiatr. 2006;28(2):153-7.
- 2. Hall W, Solowij N. Adverse effects of cannabis. Lancet. 1998;352(9140):1611-6.
- 3. Mechoulam R. Marihuana chemistry. Science. 1970;168(936):1159-66.
- 4. Devane WA, Dysarz FA 3rd, Johnson MR, Melvin LS, Howlett AC. Determination and characterization of a cannabinoid receptor in rat brain. Mol Pharmacol. 1988;34(5):605-13.
- 5. Devane WA, Hanus L, Breuer A, Pertwee RG, Stevenson LA, Griffin G, Gibson D, Mandelbaum A, Etinger A, Mechoulam R. Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science. 1992;258(5090):1946-9.
- 6. Howlett AC, Barth F, Bonner TI, Cabral G, Casellas P, Devane WA, Felder CC, Herkenham M, Mackie K, Martin BR, Mechoulam R, Pertwee RG. International Union of Pharmacology. XXVII. Classification of cannabinoid receptors. Pharmacol Rev. 2002;54(2):161-202.
- 7. Mechoulam R, Ben-Shabat S, Hanus L, Ligumsky M, Kaminski NE, Schatz AR, Gopher A, Almog S, Martin BR, Compton DR, Pertwee RG, Griffin G, Bayewitch M, Barg J, Vogel Z. Identification of an endogenous 2-monoglyceride, present in canine gut, that binds to cannabinoid receptors. Biochem Pharmacol. 1995;50(1):83-90.
- 8. De Petrocellis L, Di Marzo V. An introduction to the endocannabinoid system: from the early to the latest concepts. Best Pract Res Clin Endocrinol Metab. 2009;23(1):1-15.
- 9. Ross RA. Anandamide and vanilloid TRPV1 receptors. Br J Pharmacol. 2003;140(5):790-801.
- 10. Ross RA. Allosterism and cannabinoid CB(1) receptors: the shape of things to come. Trends Pharmacol Sci. 2007;28(11):567-72.
- 11. Burnstock G. Autonomic neurotransmission: 60 years since sir Henry Dale. Annu Rev Pharmacol Toxicol. 2009;49:1-30.
- 12. Wotjak CT, Landgraf R, Engelmann M. Listening to neuropeptides by microdialysis: echoes and new sounds? Pharmacol Biochem Behav. 2008;90(2):125-34.
- 13. Piomelli D. The molecular logic of endocannabinoid signalling. Nat Rev Neurosci. 2003;4(11):873-84.
- 14. Egertová M, Giang DK, Cravatt BF, Elphick MR. A new perspective on cannabinoid signalling: complementary localization of fatty acid amide hydrolase and the CB1 receptor in rat brain. Proc Biol Sci. 1998;265(1410):2081-5.
- 15. Di Marzo V, Fontana A, Cadas H, Schinelli S, Cimino G, Schwartz JC, Piomelli D. Formation and inactivation of endogenous cannabinoid anandamide in central neurons. Nature. 1994;372(6507):686-91.
- 16. Beltramo M, Stella N, Calignano A, Lin SY, Makriyannis A, Piomelli D. Functional role of high-affinity anandamide transport, as revealed by selective inhibition. Science. 1997;277(5329):1094-7.
- 17. Giuffrida A, Beltramo M, Piomelli D. Mechanisms of endocannabinoid inactivation: biochemistry and pharmacology. J Pharmacol Exp Ther. 2001;298(1):7-14.
- 18. Glaser ST, Abumrad NA, Fatade F, Kaczocha M, Studholme KM, Deutsch DG. Evidence against the presence of an anandamide transporter. Proc Natl Acad Sci U S A. 2003;100(7):4269-74.
- 19. Glaser ST, Kaczocha M, Deutsch DG. Anandamide transport: a critical review. Life Sci. 2005;77(14):1584-604.
- 20. Cravatt BF, Giang DK, Mayfield SP, Boger DL, Lerner RA, Gilula NB. Molecular characterization of an enzyme that degrades neuromodulatory fatty-acid amides. Nature. 1996;384(6604):83-7.
- 21. Dinh TP, Carpenter D, Leslie FM, Freund TF, Katona I, Sensi SL, Kathuria S, Piomelli D. Brain monoglyceride lipase participating in endocannabinoid inactivation. Proc Natl Acad Sci U S A. 2002;99(16):10819-24.
- 22. Pertwee RG. Ligands that target cannabinoid receptors in the brain: from THC to anandamide and beyond. Addict Biol. 2008;13(2):147-59.
- 23. Compton DR, Johnson MR, Melvin LS, Martin BR. Pharmacological profile of a series of bicyclic cannabinoid analogs: classification as cannabimimetic agents. J Pharmacol Exp Ther. 1992;260(1):201-9.
- 24. Martin BR, Compton DR, Thomas BF, Prescott WR, Little PJ, Razdan RK, Johnson MR, Melvin LS, Mechoulam R, Ward SJ. Behavioral, biochemical, and molecular modeling evaluations of cannabinoid analogs. Pharmacol Biochem Behav. 1991;40(3):471-8.
- 25. Monory K, Blaudzun H, Massa F, Kaiser N, Lemberger T, Schütz G, Wotjak CT, Lutz B, Marsicano G. Genetic dissection of behavioural and autonomic effects of Delta(9)-tetrahydrocannabinol in mice. PLoS Biol. 2007;5(10):e269.
- 26. Izzo AA, Borrelli F, Capasso R, Di Marzo V, Mechoulam R. Non-psychotropic plant cannabinoids: new therapeutic opportunities from an ancient herb. Trends Pharmacol Sci. 2009;30(10):515-27.
- 27. Zuardi AW. Cannabidiol: from an inactive cannabinoid to a drug with wide spectrum of action. Rev Bras Psiquiatr. 2008;30(3):271-80.
- 28. Zuardi AW, Crippa JA, Hallak JE, Moreira FA, Guimarães FS. Cannabidiol, a Cannabis sativa constituent, as an antipsychotic drug. Braz J Med Biol Res. 2006;39(4):421-9.
- 29. Beltramo M, Stella N, Calignano A, Lin SY, Makriyannis A, Piomelli D. Functional role of high-affinity anandamide transport, as revealed by selective inhibition. Science. 1997;277(5329):1094-7.
- 30. Kathuria S, Gaetani S, Fegley D, Valiño F, Duranti A, Tontini A, Mor M, Tarzia G, La Rana G, Calignano A, Giustino A, Tattoli M, Palmery M, Cuomo V, Piomelli D. Modulation of anxiety through blockade of anandamide hydrolysis. Nat Med. 2003;9(1):76-81.
- 31. Piomelli D, Tarzia G, Duranti A, Tontini A, Mor M, Compton TR, Dasse O, Monaghan EP, Parrott JA, Putman D. Pharmacological profile of the selective FAAH inhibitor KDS-4103 (URB597). CNS Drug Rev. 2006;12(1):21-38.
- 32. Hohmann AG, Suplita RL, Bolton NM, Neely MH, Fegley D, Mangieri R, Krey JF, Walker JM, Holmes PV, Crystal JD, Duranti A, Tontini A, Mor M, Tarzia G, Piomelli D. An endocannabinoid mechanism for stress-induced analgesia. Nature. 2005;435(7045):1108-12.
- 33. Long JZ, Li W, Booker L, Burston JJ, Kinsey SG, Schlosburg JE, Pavón FJ, Serrano AM, Selley DE, Parsons LH, Lichtman AH, Cravatt BF. Selective blockade of 2-arachidonoylglycerol hydrolysis produces cannabinoid behavioral effects. Nat Chem Biol. 2009;5(1):37-44.
- 34. Rinaldi-Carmona M, Barth F, Héaulme M, Shire D, Calandra B, Congy C, Martinez S, Maruani J, Néliat G, Caput D, et al. SR141716A, a potent and selective antagonist of the brain cannabinoid receptor. FEBS Lett. 1994;350(2-3):240-4.
- 35. BisognoT, Cascio MG, Saha B, Mahadevan A, Urbani P, Minassi A, Appendino G, Saturnino C, Martin B, Razdan R, Di Marzo V. Development of the first potent and specific inhibitors of endocannabinoid biosynthesis. Biochim Biophys Acta. 2006;1761(2):205-12.
- 36. Moreira FA, Crippa JA. The psychiatric side-effects of rimonabant. Rev Bras Psiquiatr. 2009;31(2):145-53.
- 37. Herkenham M, Lynn AB, Little MD, Johnson MR, Melvin LS, de Costa BR, Rice KC. Cannabinoid receptor localization in brain. Proc Natl Acad Sci U S A. 1990;87(5):1932-6.
- 38. Hill MN, Gorzalka BB. Is there a role for the endocannabinoid system in the etiology and treatment of melancholic depression? Behav Pharmacol. 2005;16(5-6):333-52.
- 39. Haller J, Varga B, Ledent C, Barna I, Freund TF. Context-dependent effects of CB1 cannabinoid gene disruption on anxiety-like and social behaviour in mice. Eur J Neurosci. 2004;19(7):1906-12.
- 40. Martin M, Ledent C, Parmentier M, Maldonado R, Valverde O. Involvement of CB1 cannabinoid receptors in emotional behaviour. Psychopharmacology (Berl). 2002;159(4):379-87.
- 41. Kamprath K, Marsicano G, Tang J, Monory K, Bisogno T, Di Marzo V, Lutz B, Wotjak CT. Cannabinoid CB1 receptor mediates fear extinction via habituation-like processes. J Neurosci. 2006;26(25):6677-86.
- 42. Steiner MA, Wanisch K, Monory K, Marsicano G, Borroni E, Bächli H, Holsboer F, Lutz B, Wotjak CT. Impaired cannabinoid receptor type 1 signaling interferes with stress-coping behavior in mice. Pharmacogenomics J. 2008;8(3):196-208.
- 43. Marsicano G, Wotjak CT, Azad SC, Bisogno T, Rammes G, Cascio MG, Hermann H, Tang J, Hofmann C, Zieglgänsberger W, Di Marzo V, Lutz B. The endogenous cannabinoid system controls extinction of aversive memories. Nature. 2002;418(6897):530-4.
- 44. Hölter SM, Kallnik M, Wurst W, Marsicano G, Lutz B, Wotjak CT. Cannabinoid CB1 receptor is dispensable for memory extinction in an appetitively-motivated learning task. Eur J Pharmacol. 2005;510(12):69-74.
- 45. Hill MN, Patel S, Carrier EJ,Rademacher DJ, Ormerod BK, Hillard CJ,Gorzalka BB. Downregulation of endocannabinoid signaling in the hippocampus following chronic unpredictable stress. Neuropsychopharmacology. 2005;30(3):508-15.
- 46. Patel S, Roelke CT, Rademacher DJ, CullinanWE, Hillard CJ. Endocannabinoid signaling negatively modulates stress-induced activation of the hypothalamic-pituitary-adrenal axis. Endocrinology. 2004;145(12): 5431-8.
- 47. Steiner MA, Wotjak CT. Role of the endocannabinoid system in regulation of the hypothalamic-pituitary-adrenocortical axis. Prog Brain Res. 2008;170:397-432.
- 48. Hill MN, Hillard CJ, Bambico FR, Patel S, Gorzalka BB, Gobbi G. The therapeutic potential of the endocannabinoid system for the development of a novel class of antidepressants. Trends Pharmacol Sci. 2009;30(9):484 93.
- 49. Giuffrida A, Leweke FM, Gerth CW, Schreiber D, Koethe D, Faulhaber J, Klosterkötter J, Piomelli D. Cerebrospinal anandamide levels are elevated in acute schizophrenia and are inversely correlated with psychotic symptoms. Neuropsychopharmacology. 2004;29(11):2108-14.
- 50. Griebel G, Stemmelin J, Scatton B. Effects of the cannabinoid CB1 receptor antagonist rimonabant in models of emotional reactivity in rodents. Biol Psychiatry. 2005;57(3):261-7.
- 51. Witkin JM, Tzavara ET, Davis RJ, Li X, Nomikos GG. A therapeutic role for cannabinoid CB1 receptor antagonists in major depressive disorders. Trends Pharmacol Sci. 2005;26(12):609-17.
- 52. Moreira FA, Lutz B. The endocannabinoid system: emotion, learning and addiction. Addict Biol. 2008;13(2):196-212.
- 53. Pamplona FA, Prediger RD, Pandolfo P, Takahashi RN. The cannabinoid receptor agonist WIN 55,212-2 facilitates the extinction of contextual fear memory and spatial memory in rats. Psychopharmacology (Berl). 2006;188(4):641-9.
- 54. Pamplona FA, Takahashi RN. WIN 55212-2 impairs contextual fear conditioning through the activation of CB1 cannabinoid receptors. Neurosci Lett. 2006;397(1-2):88-92.
- 55. Bambico FR, Katz N, Debonnel G, Gobbi G. Cannabinoids elicit antidepressant-like behavior and activate serotonergic neurons through the medial prefrontal cortex. J Neurosci. 2007;27(43):11700-11.
- 56. Hill MN, Gorzalka BB. Pharmacological enhancement of cannabinoid CB1 receptor activity elicits an antidepressant-like response in the rat forced swim test. Eur Neuropsychopharmacol. 2005;15(6):593-9.
- 57. Moreira FA, Aguiar DC, Campos AC, Lisboa SF, Terzian AL, Resstel LB, Guimarães FS. Antiaversive effects of cannabinoids: is the periaqueductal gray involved? Neural Plast. 2009;2009:625469.
- 58. Moreira FA, Wotjak CT. Cannabinoids and anxiety. In: Current Topics in Behavioral Neuroscience: Behavioral Neurobiology of Anxiety and its Treatment Berlin: Springer; In press 2010.
- 59. Bortolato M, Campolongo P, Mangieri RA, Scattoni ML, Frau R, Trezza V, La Rana G, Russo R, Calignano A, Gessa GL, Cuomo V, Piomelli D. Anxiolytic-like properties of the anandamide transport inhibitor AM404. Neuropsychopharmacology. 2006;31(12):2652-9.
- 60. Patel S, Hillard CJ. Pharmacological evaluation of cannabinoid receptor ligands in a mouse model of anxiety: further evidence for an anxiolytic role for endogenous cannabinoid signaling. J Pharmacol Exp Ther. 2006;318(1):304-11.
- 61. Bitencourt RM, Pamplona FA, Takahashi RN. Facilitation of contextual fear memory extinction and anti-anxiogenic effects of AM404 and cannabidiol in conditioned rats. Eur Neuropsychopharmacol. 2008;18(12):849-59.
- 62. Chhatwal JP, Davis M, Maguschak KA, Ressler KJ. Enhancing cannabinoid neurotransmission augments the extinction of conditioned fear. Neuropsychopharmacology. 2005;30(3):516-24.
- 63. Haller J, Barna I, Barsvari B, Gyimesi Pelczer K, Yasar S, Panlilio LV, Goldberg S. Interactions between environmental aversiveness and the anxiolytic effects of enhanced cannabinoid signaling by FAAH inhibition in rats. Psychopharmacology (Berl). 2009;204(4):607-16.
- 64. Micale V, Cristino L, Tamburella A, Petrosino S, Leggio GM, Drago F, Di Marzo V. Anxiolytic effects in mice of a dual blocker of fatty acid amide hydrolase and transient receptor potential vanilloid type-1 channels. Neuropsychopharmacology. 2009;34(3):593-606.
- 65. Moreira FA, Kaiser N, Monory K, Lutz B. Reduced anxiety-like behaviour induced by genetic and pharmacological inhibition of the endocannabinoid-degrading enzyme fatty acid amide hydrolase (FAAH) is mediated by CB1 receptors. Neuropharmacology. 2008;54(1):141-50.
- 66. Bortolato M, Mangieri RA, Fu J, Kim JH, Arguello O, Duranti A, Tontini A, Mor M, Tarzia G, Piomelli D. Antidepressant-like activity of the fatty acid amide hydrolase inhibitor URB597 in a rat model of chronic mild stress. Biol Psychiatry. 2007;62(10):1103-10.
- 67. Gobbi G, Bambico FR, Mangieri R, Bortolato M, Campolongo P, Solinas M, Cassano T, Morgese MG, Debonnel G, Duranti A, Tontini A, Tarzia G, Mor M, Trezza V, Goldberg SR, Cuomo V, Piomelli D. Antidepressant-like activity and modulation of brain monoaminergic Endocanabinoides, depressão e ansiedade transmission by blockade of anandamide hydrolysis. Proc Natl Acad Sci U S A. 2005;102(51):18620-5.
- 68. Högestätt ED, Jönsson BA, Ermund A, Andersson DA, Björk H, Alexander JP, Cravatt BF, Basbaum AI, Zygmunt PM. Conversion of acetaminophen to the bioactive N-acylphenolamine AM404 via fatty acid amide hydrolase-dependent arachidonic acid conjugation in the nervous system. J Biol Chem. 2005;280(36):31405-12.
- 69. Umathe SN, Manna SS, Utturwar KS, Jain NS. Endocannabinoids mediate anxiolytic-like effect of acetaminophen via CB1 receptors. Prog Neuropsychopharmacol Biol Psychiatry. 2009;33(7):1191-9.
- 70. Marsch R, Foeller E, Rammes G, Bunck M, Kössl M, Holsboer F, Zieglgänsberger W, Landgraf R, Lutz B, Wotjak CT. Reduced anxiety, conditioned fear, and hippocampal long-term potentiation in transient receptor potential vanilloid type 1 receptor-deficient mice. J Neurosci. 2007;27(4):832-9.
Datas de Publicação
-
Publicação nesta coleção
24 Maio 2010 -
Data do Fascículo
Maio 2010