Resumos
Racional:
A gastrectomia laparoscópica é relativamente recente em função da dificuldade técnica relacionada à linfadenectomia e reconstrução. Até o momento, não se tem uma técnica ou dispositivo para realizar a anastomose esofagojejunal por laparoscopia que seja segura, de baixo custo e rápida execução.
Objetivo
: Apresentar técnica proposta pelos autores com seus detalhes técnicos de reconstrução com "ogiva reversa".
Método
: Após gastrectomia total completamente intra-corpórea, a reconstrução inicia-se com o preparo do esôfago intra-abdominal, com secção transversal de 50%, próximo a transição esofagogástrica. O dispositivo é preparado usando as sondas de Levine (nº.14 e 10), com 3 cm de comprimento, ligado à ogiva do grampeador circular (nº. 25) e um fio agulhado (2-0 ou 3-0) de 10 cm, ligado ao final do dispositivo que é introduzido no sentido inverso ao esôfago; ele é amputado e o fio puxado em seguida, posicionando a ogiva no esôfago distal. O jejuno a 20-30 cm do ângulo duodenojejunal é seccionado, introduzindo-se o grampeador no jejuno e conectando-o à ogiva, previamente posicionada no esôfago. Grampeador linear (azul de 60 mm) é utilizado para fechar a abertura do "cajado" do jejuno.
Conclusão:
A técnica de "ogiva reversa" utilizada pelos autores, facilitou a reconstrução do trânsito digestivo, contribuindo para diminuir as dificuldades técnicas na sua reconstrução após gastrectomia total.
Reconstrução por laparoscopia; Anastomose esofagojejunal; Ogiva reversa; Gastrectomia; Cancer gástrico
Background:
The laparoscopic gastrectomy is a relatively new procedure due mainly to the difficulties related to lymphadenectomy and reconstruction. Until the moment, technique or device to perform the esophagojejunal anastomosis by laparoscopy is still a challenge. So, a safe, cheap and quickly performing technique is desirable to be developed.
Aim
: To present technique proposed by the authors with its technical details on reconstruction with "reverse anvil".
Method:
After total gastrectomy completed intra-corporeally, the reconstruction starts with the preparation of the intra-abdominal esophagus cross-section next to the esophagogastric transition of 50%. A graduated device is prepared using Levine gastric tubes (nº. 14 and 10), 3 cm length, connected to the anvil of the circular stapler (nº. 25) with a wire thread (2-0 or 3-0) of 10 cm, which is connected to end of this device. The whole device is introduced in reverse esophagus. The esophagus is amputated and the wire is pulled after previous transfixation in the distal esophagus and the anvil positioned. The jejunal loop is sectioned 20-30 cm from duodenojejunal angle, and the anvil put in the jejunal loop and connect previously in the esophagus. Linear stapler (blue 60 mm) is used to close the opening of the jejunal loop.
Conclusion:
The "reverse anvil" technique used by the authors facilitated the transit reestablishment after total gastrectomy, contributing to obviate reconstruction problems after total gastrectomy.
Reconstruction by laparoscopy; Esophagojejunal anastomosis; Reverse anvil; Gastrectomy; Gastric cancer
INTRODUÇÃO
A história oficial da ressecção gástrica laparoscópica começa em Singapura, em 1992, quando Goh et al., realizou a primeira ressecção distal com reconstrução à Billroth II em um paciente idoso portador de úlcera gástrica crônica55. Goh P, Tekant Y, Kum CK, Isaac J, Shang NS. Totally intra-abdominal laparoscopic Billroth II gastrectomy. Surg Endosc. 1992 May-Jun;6(3):160.. A primeira gastrectomia laparoscópica com reconstrução à Billroth II para tratamento do câncer foi realizada por Kitano et al.99. Kitano S, Iso Y, Moriyama M, Sugimachi K. Laparoscopy-assisted Billroth I gastrectomy. Surg Laparosc Endosc. 1994 Apr;4(2):146-8., em 1992 e publicado em 1994. Na Bélgica, em junho de 1993, Azagra et al.11. Azagra JS, Goergen M, Ansay J, De Simone P, Vanhaverbeek M, Devuyst L, et al. Laparoscopic gastric reduction surgery. Preliminary results of a randomized, prospective trial of laparoscopic vs open vertical banded gastroplasty. Surg Endosc. 1999 Jun;13(6):555-8.,22. Azagra JS, Goergen M, De Simone P, Ibanez-Aguirre J. Minimally invasive surgery for gastric cancer. Surg Endosc. 1999 Apr;13(4):351-7., realizou a primeira gastrectomia total para o tratamento do câncer gástrico, e em 1999, relatou sua experiência com 13 pacientes, concluindo que a laparoscopia para tratamento do câncer gástrico é factível, oncologicamente segura, devendo ser utilizada para pacientes com lesões iniciais, reservando-se a operação combinada (videoassistida) para lesões mais avançadas. Em 2006, este mesmo autor participou de um estudo multicêntrico, onde foram analisados 130 pacientes portadores de adenocarcinoma gástrico, seguidos por 49 meses em média, concluindo que a gastrectomia laparoscópica com qualquer tipo de linfadenectomia e mesmo como método paliativo é operação segura, com aceitável morbimortalidade em pacientes com câncer gástrico avançado, usualmente em más condições clínicas, e que a laparoscopia para doenças localizadas, é equivalente à operação aberta com mesmos resultados oncológicos e as vantagens já referidas para a laparoscopia77. Ibanez Aguirre FJ, Azagra JS, Erro Azcarate ML, Goergen M, Rico Selas P, Moreno Elola-Olaso A, et al. Laparoscopic ga strectomy for gastric adenocarcinoma. Long-term results. Rev Esp Enferm Dig. 2006 Jul;98(7):491-500.. Kitano et al.1010. Kitano S, Shiraishi N, Uyama I, Sugihara K, Tanigawa N. A multicenter study on oncologic outcome of laparoscopic gastrectomy for early cancer in Japan. Ann Surg. 2007 Jan;245(1):68-72., em 2007, publicou um estudo multicêntrico no Japão, para câncer gástrico precoce, mostrando que a operação laparoscópica é associada ao menor tempo de internação hospitalar, menor dor pós-operatória, melhor resultado estético e sobrevida livre de doença aos cinco anos semelhante à operação aberta para os estádios I e II.
Um estudo italiano, comparando gastrectomia videoassistida com a aberta também não demonstrou diferenças em relação à sobrevida, com média de ressecção linfonodal superior na técnica videoassistida, tempo de operação e morbidade maior para a laparotômica1515. Orsenigo E, Di Palo S, Tamburini A, Staudacher C. Laparoscopy-assisted gastrectomy versus open gastrectomy for gastric cancer: a monoinstitutional Western center experience. Surg Endosc. 2010 Jan;25(1):140-5..
Passados 17 anos da primeira ressecção laparoscópica a sociedade japonesa de câncer gástrico incluiu nas suas orientações de conduta de 2010, a abordagem laparoscópica para os cânceres em estádios 1A e 1B, tendo o cuidado de ressaltar a parcimônia com que deve-se indicar este método para o tratamento deste tipo de tumor44. Etoh T, Yasuda K, Inomata M, Shiraishi N, Kitano S. Current status of laparoscopic gastrectomy for gastric malignancies. Surg Technol Int. 2010 Oct;20:153-7.. Kodera et al.1111. Kodera Y, Fujiwara M, Ohashi N, Nakayama G, Koike M, Morita S, et al. Laparoscopic surgery for gastric cancer: a collective review with meta-analysis of randomized trials. J Am Coll Surg. 2010 Nov;211(5):677-86., publicou em 2010, metanálise com o objetivo de tentar responder as controvérsias existentes, concluindo que a laparoscopia com linfadenectomia à D2 é factível, segura, obedece aos princípios oncológicos e deve ser realizada em centros com volume, formação e experiência suficientes para realizar o procedimento. No entanto, não há diferenças significativas em relação à morbidade e mortalidade e segurança oncológica em vários estudos randomizados ou não, no tocante ao câncer gástrico precoce1717. Sun J, Li J, Wang J, Pan T, Zhou J, Fu X, et al. Meta-analysis of randomized controlled trials on laparoscopic gastrectomy vs. open gastrectomy for distal gastric cancer. Hepatogastroenterology. 2012 Sep;59(118):1699-705.,1818. Vinuela EF, Gonen M, Brennan MF, Coit DG, Strong VE. Laparoscopic versus open distal gastrectomy for gastric cancer: a meta-analysis of randomized controlled trials and high-quality nonrandomized studies. Ann Surg. 2012 Mar;255(3):446-56.. A experiência no ocidente é pequena, devido ao pequeno número de câncer precoce e quase não há trabalhos relacionados ao câncer gástrico avançado33. Azagra JS, Ibanez-Aguirre JF, Goergen M, Ceuterick M, Bordas-Rivas JM, Almendral-Lopez ML, et al. Long-term results of laparoscopic extended surgery in advanced gastric cancer: a series of 101 patients. Hepatogastroenterology. 2006 Mar-Apr;53(68):304-8.,66. Huscher GC, Mingoli A, Sgarzini G, Sansonetti A, Lirici M, Napoletano C, et al. Extended indications of laparoscopic procedures to advanced gastric cancer. Surg Endosc. 2005 May;19(5):737; author reply 8. ,1414. Mingoli A, Sgarzini G, Binda B, Brachini G, Belardi V, Huscher CG, et al. Totally laparoscopic approach for treatment of early and advanced gastric cancer. J Am Coll Surg. 2007 Jan;204(1):187-8.,1919. Wang DR, Zhao JG, Yu HF, Wang LH, Jiang GQ, Li YK, et al. [Laparoscopic versus open surgery for D2 gastrectomy in advanced gastric cancer]. Zhonghua Wei Chang Wai Ke Za Zhi. 2012 Sep;15(9):964-6..
Assim, ao longo dos anos da videocirurgia, várias técnicas de reconstrução da anastomose esofagojejunal foram criadas, como: técnicas videoassistidas, anastmose manual intracorpórea, grampeamento laterolateral do esôfago, dispostivos transorais, entre outros11. Azagra JS, Goergen M, Ansay J, De Simone P, Vanhaverbeek M, Devuyst L, et al. Laparoscopic gastric reduction surgery. Preliminary results of a randomized, prospective trial of laparoscopic vs open vertical banded gastroplasty. Surg Endosc. 1999 Jun;13(6):555-8.,88. Kim HS, Kim BS, Lee IS, Lee S, Yook JH. Intracorporeal laparoscopic Roux-en-Y gastrojejunostomy after 95% gastrectomy for early gastric cancer in the upper third of the stomach: a report on 21 cases. J Laparoendosc Adv Surg Tech A. 2013 Mar;23(3):250-7.,1212. Kojima K, Inokuchi M, Kato K, Motoyama K, Sugihara K. Petersen's hernia after laparoscopic distal gastrectomy with Roux-en-Y reconstruction for gastric cancer. Gastric Cancer. 2013 Apr 5.,1313. Marangoni G, Villa F, Shamil E, Botha AJ. OrVil-assisted anastomosis in laparoscopic upper gastrointestinal surgery: friend of the laparoscopic surgeon. Surg Endosc. 2012 Mar;26(3):811-7.,1616. Shim JH, Yoo HM, Oh SI, Nam MJ, Jeon HM, Park CH, et al. Various types of intracorporeal esophagojejunostomy after laparoscopic total gastrectomy for gastric cancer. Gastric Cancer. 2013 Jul;16(3):420-7.. Apesar de várias técnicas disponíveis para a anastomose esofagojejunal, não existe uma por videocirurgia intracorpórea que seja realmente eficaz, reproduzível, barata e rápida.
O objetivo deste trabalho é apresentar técnica proposta pelos autores com seus detalhes técnicos de reconstrução com "ogiva reversa".
TÉCNICA
Posição dos portais
Os passos cirúrgicos iniciais da gastrectomia total e linfadenectomia D2 são semelhantes, seguindo os mesmos padrões técnicos do procedimento convencional (aberto). O posicionamento do doente é em litotomia com membros inferiores estendidos, afastados e adequadamente amparados em perneira apropriada; o cirurgião fica entre as pernas e os auxiliares à esquerda do paciente (câmera e apresentação). O monitor, quando único, posiciona-se na cabeceira a direita da mesa operatória. Os portais são em número de seis (Figura1).
Disposição dos trocárteres para gastrectomia em formato de uma "casa": P1 - trocarte de 11 mm na cicatriz umbilical (ótica de 10 mm e 30 graus); P2, P3 - trocárteres de 12 mm flancos esquerdo e direito; P5 e P6 - hipocôndrios direito e esquerdo, na linha que passa pelo mamilo (trabalho - cirurgião); P4 - trocarte de 5 mm sub-xifóide (afastador).
Após a ressecção do estômago e linfadenectomia D2, segue-se o preparo do esôfago para a reconstrução do trânsito intestinal em Y-de-Roux. Este preparo inicia-se com a dissecção do tecido adjacente em direção ao hiato esofágico, rente ao ramo direito do pilar diafragmático e do ligamento gastrofrênico liberando o esôfago em 360º, com o 2º auxiliar tracionando o esôfago anterior e inferiormente, incluindo a cadeia linfonodal 1 (paracárdica direita) e a linfonodal 3 (pequena curvatura).
Preparação para posicionar a ogiva preferencialmente de 25 mm
O cirurgião P2 passa sua pinça posteriormente ao esôfago com uma fita cardíaca de cerca de 10 cm a 15 cm e por P6 apreende sua extremidade, ou vice-versa, tracionando e amarrando firmemente na porção distal do esôfago para servir de reparo para tração e fechamento do esôfago distal. O cirurgião então apreende a fita com grasper ou porta-agulhas através de P6 e antes de iniciar a secção do esôfago pede que o esôfago seja aspirado através de sonda nasogástrica para retirada de líquido e secreções que possam estar presentes, sendo a sonda retirada em seguida. Então inicia-se a secção do esôfago em sua porção mais distal da sua esquerda para a direita transversalmente ao órgão até aproximadamente 50% da largura do esôfago - atenção especial deve ser dada à altura da secção esofágica em lesões da transição para obter margem livre (Figura 2).
A) Preparo do esôfago para abertura na face anterolateral direita (marcado de azul na primeira imagem); B) abertura com pinça Harmonic ACE; C) esôfago aberto por onde será introduzido a ogiva do grampeador circular.
Passagem da ogiva
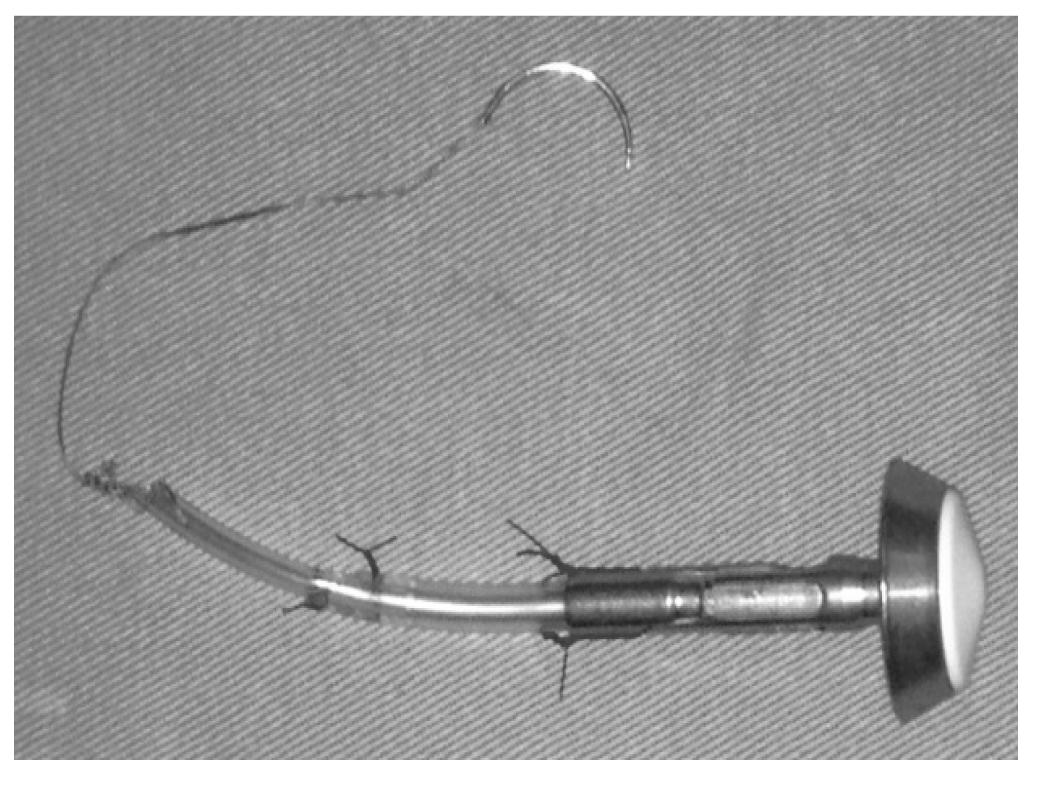
Procede-se a ampliação da incisão em P6 para que possa ser introduzida na cavidade a ogiva do grampeador circular, preparada conforme descrição da Figura 3.
Este dispositivo é criado utilizando duas sondas de Levine de 3 cm cada, números 14 e 10, e uma ogiva de grampeador circular de 21 mm ou preferencialmete de 25 mm. A sonda 14 é acoplada na ogiva, a qual é fixada com dois pontos de prolene 3-0; posteriormente, introduz-se a sonda de 10 (apenas 0,5 cm) dentro da sonda de 14, fixando-a com pontos de prolene 3-0. Em seguida é transfixada a ponta da sonda de Levine 10 com fio de 10 a 15 cm de Vicryl 2-0 (J333) ou outro fio 2-0 com agulha de 2,5.
Feito isso, a ogiva é introduzida na cavidade e reposicionada novamente a cânula para P6 com a ajuda de pinça tipo Backaus para que não ocorra escape de gás. Para introduzir a ogiva no esôfago o cirurgião apreende-a com pinça própria a este fim por P6, apreende também a borda proximal lateral do esôfago seccionado por P2 tracionando-a de modo a expor a luz do órgão, enquanto o 1º auxiliar apreende a porção distal do esôfago ou a fita cardíaca, tracionando lateralmente no sentido oposto ao do cirurgião. A ogiva é introduzida por cerca de 4 a 5 cm no órgão. O cirurgião então através de P6 toma a agulha através de porta-agulhas e passa-a na porção lateroanterior do esôfago a cerca de 1 cm a 1,5 cm da borda de secção, local em que posteriormente será exteriorizada a haste da ogiva. O fio é tracionado de maneira que a ogiva permaneça a cerca de 4 cm do bordo de secção e que o fio esteja bem tracionado no interior do órgão de maneira que não seja atingido pela linha de grampeamento que será aplicada para o fechamento do órgão (Figura 4).
A) Introdução da ogiva pela abertura do esôfago; B) passagem da agulha na parede anterior do esôfago, aproximadamente 1,5 cm acima da abertura; C) amputação do esôfago, tendo cuidado para não seccionar o fio previamente passado, utilizando um grampeador linear laparoscópico de 60 mm, preferencialmente com carga azul.
Secção do esôfago e tração da ogiva
Certificado o bom posicionamento da ogiva e fio o cirurgião através de P3 introduz grampeador linear 60 mm carga azul que será aplicado ao esôfago; por P6 exerce tração lateral à sua esquerda enquanto o 1º auxiliar traciona em direção contrária tomando a fita cardíaca ou a porção distal do esôfago. O endogrampeador então é posicionado de forma a ficar entre o fio ligado a ogiva e a borda de secção do esôfago fechando completamente o esôfago proximal e completando então a secção da peça que será extraída (esôfago distal, estômago, omento e linfadenectomia). A peça seccionada é levada para o hipocôndrio direito, logo abaixo do fígado para que não atrapalhe as próximas etapas. O cirurgião então por P2 e P6 utiliza preferencialmente dois porta-agulhas para tracionar o fio exteriorizado pelo esôfago de maneira cuidadosa, enquanto o 2º auxiliar P3 gentilmente mantém o esôfago posicionado, sendo também assistido pelo 1º auxiliar P5 para boa apresentação. Movimentos circulares suaves podem ser úteis. Após a completa exteriorização da haste da ogiva as sondas anexadas a ela são retiradas cortando-se os fios que a ela prendem. Nesse momento pode-se proceder limpeza com SF 0,9% de todo o hipocôndrio esquerdo inserindo aspirador por P5 pelo 1º auxiliar. Também caso a linfadenectomia das cadeias 11p, 11d e eventualmente a 10 ainda não tenham sido realizadas, podem então ser feitas com muita tranquilidade e com boa exposição, com o 1º auxiliar tracionando o tecido superiormente através de P5, o cirurgião por P2 tracionando posteriormente e por P6 realizando a dissecção com pinça ultrassônica (Figura 5).
A) Tração delicada do fio; B) saída das sondas de Levine; C) posicionamento da ogiva no esôfago distal
Abertura do mesocólon e secção da alça de jejuno (técnica transmesocólica)
O 1º auxiliar toma o cólon transverso em sua porção à esquerda e traciona-o anterosuperiormente de forma a apresentar o mesocólon ao cirurgião que o apreende em sua porção média, lateralmente a veia cólica média através de P2, e por P6 inicia sua abertura com a pinça ultrassônica criando solução de continuidade que permita a passagem da alça de jejuno que será anastomosada ao esôfago. O 2º auxiliar P3 mantém o cólon tracionado em direção cefálica através de preensão do próprio cólon ou mesocólon. O 1º auxiliar P5 ajuda o cirurgião na exposição das alças para a localização do ângulo duodenojejunal e determinação do ponto de secção da alça, geralmente de 25 a 30 cm desse ângulo. O cirurgião P2 apreende a alça de jejuno próxima ao local de secção e a traciona lateralmente à sua esquerda enquanto o 1º auxiliar P5 apreende a mesma alça a cerca de 5 cm da pega do cirurgião, tracionando-a lateralmente em direção ao baço. O cirurgião P6 promove a abertura do mesentério bem próximo à parede da alça de delgado de maneira a permitir a passagem do endogrampeador. Em seguida o cirurgião insere o endogrampeador por P6 introduzindo a haste mais fina na abertura criada no mesentério certificando-se que a alça encontra-se na sua totalidade entre as hastes e que nenhuma outra estrutura indesejada esteja entre as mesmas. Procede-se o grampeamento e secção da alça. Em seguida a alça é passada através da abertura do mesocólon. O cirurgião P2 apreende a extremidade a sua esquerda da abertura do mesocólon; o 1º auxiliar P5 apreende a extremidade à sua direita da abertura do mesocólon; o cirurgião P6 apreende a extremidade distal da alça seccionada levando-a através da abertura do mesocólon e cessa o movimento; e em seguida P2 e P5 apreendem o cólon tracionando-o caudalmente de modo a expor a alça jejunal que será anastomosada ao esôfago. O cirurgião e o 1º auxiliar posicionam a alça de modo que a extremidade seccionada fique direcionada à esquerda do paciente.
Abertura da alça alimentar e anastomose esofagojejunal
O 1º auxiliar P5 apreende a extremidade da alça na região do grampeamento; o cirurgião P2 apreende a alça a cerca de 3 cm de sua extremidade tracionando em sentido oposto ao 1º auxiliar e por P6 com a pinça ultrassônica promove a abertura da alça em cerca de 50% da parede da mesma. Neste momento o 2º auxiliar assume o controle da ótica e o 1º auxiliar retira a cânula de P6, por onde introduz o grampeador circular 21 mm a 25 mm de acordo com o calibre das alças e utiliza o Backaus para minimizar a perda de gás ao redor do grampeador. O 1º auxiliar em P5 apreende a extremidade lateral da alça aberta; o cirurgião P2 apreende a extremidade medial da alça tracionando em sentido oposto ao 1º auxiliar; o 2º auxiliar P3 apreende a alça a cerca de 5 a 6 cm de sua extremidade e traciona em direção ao diafragma. O 1º auxiliar então introduz o grampeador na alça por cerca de 5 cm, mantendo o conjunto alça/grampeador estável. O 2º auxiliar P3 apreende a alça a cerca de 3 a 4 cm da extremidade do grampeador circular e a traciona em direção à pelve, mantendo a alça bem tracionada para que o cirurgião perfure e exponha a haste que será encaixada na ogiva. O cirurgião P2 apreende a haste da ogiva com pinça apropriada e a guia até haver o completo encaixe com a haste do grampeador. As extremidades proximal e distal da alça de delgado são mantidas gentilmente tracionadas até que ocorra o completo fechamento do grampeador e grampeamento. O grampeador é retirado e novamente a cânula em P6 é reposicionada com auxilio de Backaus. O coto de delgado deve ser fechado; para isso o 1º auxiliar P5 apreende a extremidade lateral do coto de delgado e o cirurgião P2 toma sua porção medial expondo e mesentério que pode ser dissecado P6 para a aplicação de nova carga de grampeador linear 60 mm carga azul por P6 no sentido de sua borda mesentérica para a borda anti-mesentérica. A peça pode ser retirada através de P6 (Figura 6).
A) Conexão do grampeador circular já introduzida na alça e conectada na ogiva para posterior grampeamento; B) utiliza-se um grampeador linear laparoscópico carga azul 60 mm para síntese do delgado ("ponta do cajado"); C) resultado final da anastomose esofagojejunal
Anastomose enteroenteral
O cirurgião P2 e P6 segue a alça alimentar até a distância desejada, em média a 30 cm da anastomose esofagojejunal e a entrega ao 2º auxiliar P3 que manterá sua exposição próxima à parede abdominal. Em seguida, o cirurgião P2 identifica a alça bileopancreática, apreende-a próximo à sua extremidade e mantém sua apresentação lateralmente à alça alimentar. Com P6 o cirurgião apreende a alça alimentar a cerca de 4 a 5 cm do ponto onde P3 a apreende, e apresenta-a ao 1º auxiliar que, através de P5 com um dissector ligado ao cabo monopolar de energia, realiza a cauterização e abertura da alça em sua borda anti-mesentérica para a passagem de um dos ramos do grampeador. O mesmo procedimento é realizado na alça bileopancreática. As apresentações de P3 e P2 são mantidas; o cirurgião por P6 introduz o grampeador e o 1º auxiliar por P5 com um grasper atraumático auxiliará o cirurgião a introduzir os ramos do grampeador 45 mm carga branca ou azul nos orifícios das alças. Sugere-se que seja introduzido primeiro o "ramo" de maior calibre, pois ele se mantém mais estável na alça. As alças são ajustadas de modo a ficarem simétricas e se tocando por suas bordas anti-mesentéricas; o grampeamento então é efetuado. Retirado o grampeador, o 1º auxiliar apreende a alça alimentar próximo à região da anastomose efetuada e apresenta ao cirurgião a abertura do grampeamento. O cirurgião por P2 pode utilizar um contra porta-agulhas ou uma pinça de sua preferência e por P6 introduz o porta-agulhas com fio PDS II 3-0 para realizar o fechamento da abertura através de sutura contínua em dois planos. O fechamento em plano único extramucoso também pode ser praticado. Terminada a anastomose realiza-se rotineiramente um ponto entre a alça alimentar e o ramo direito do pilar diafragmático próximo à linha de grampeamento com o cirurgião utilizando P2 e P6. O teste com azul de metileno ou azul patente não é realizado, também não é deixada sonda alimentar.
Utiliza-se dois graspers com cremalheira, o de P2 apreende a peça do estômago na região da amarradura com a fita cardíaca. O gás é fechado e o portal P6 é retirado; ampliação na incisão é realizada para cerca de 5 cm transversalmente por todos os planos da parede abdominal e um dispositivo protetor de parede, médio, é introduzido de modo a proteger a parede abdominal. O grasper com a peça do estômago é guiada para esta abertura. Para retirá-la mais facilmente recomenda-se que seja primeiramente tracionado o omento com a ajuda de pinças tipo Collins, para em seguida tracionar o estômago e completar a extração das peças. Ampliação da incisão pode ser necessária para peças maiores.
O dispositivo que protege a pequena abertura é retirado e a parede abdominal é fechada por planos de acordo com a preferência do cirurgião. O pneumoperitônio é novamente restabelecido, realizada a revisão da hemostasia e limpeza da cavidade. O primeiro dreno é posicionado através de P5 com a ajuda de um grasper em P2 ou P3 na região da anastomose esofagojejunal. P2 ou P3 mantém o dreno no local enquanto a cânula de P5 é retirada.
Este procedimento foi realizado em 164 pacientes com sucesso no Hospital de Câncer de Barretos, Barretos, SP, Brasil, com início em 2009. A casuística será motivo de outra publicação
CONCLUSÃO
A técnica de "ogiva reversa" utilizada pelos autores, facilitou a reconstrução do trânsito digestivo, contribuindo para diminuir as dificuldades técnicas na su reconstrução após gastrectomia total.
REFERENCES
-
1Azagra JS, Goergen M, Ansay J, De Simone P, Vanhaverbeek M, Devuyst L, et al. Laparoscopic gastric reduction surgery. Preliminary results of a randomized, prospective trial of laparoscopic vs open vertical banded gastroplasty. Surg Endosc. 1999 Jun;13(6):555-8.
-
2Azagra JS, Goergen M, De Simone P, Ibanez-Aguirre J. Minimally invasive surgery for gastric cancer. Surg Endosc. 1999 Apr;13(4):351-7.
-
3Azagra JS, Ibanez-Aguirre JF, Goergen M, Ceuterick M, Bordas-Rivas JM, Almendral-Lopez ML, et al. Long-term results of laparoscopic extended surgery in advanced gastric cancer: a series of 101 patients. Hepatogastroenterology. 2006 Mar-Apr;53(68):304-8.
-
4Etoh T, Yasuda K, Inomata M, Shiraishi N, Kitano S. Current status of laparoscopic gastrectomy for gastric malignancies. Surg Technol Int. 2010 Oct;20:153-7.
-
5Goh P, Tekant Y, Kum CK, Isaac J, Shang NS. Totally intra-abdominal laparoscopic Billroth II gastrectomy. Surg Endosc. 1992 May-Jun;6(3):160.
-
6Huscher GC, Mingoli A, Sgarzini G, Sansonetti A, Lirici M, Napoletano C, et al. Extended indications of laparoscopic procedures to advanced gastric cancer. Surg Endosc. 2005 May;19(5):737; author reply 8.
-
7Ibanez Aguirre FJ, Azagra JS, Erro Azcarate ML, Goergen M, Rico Selas P, Moreno Elola-Olaso A, et al. Laparoscopic ga strectomy for gastric adenocarcinoma. Long-term results. Rev Esp Enferm Dig. 2006 Jul;98(7):491-500.
-
8Kim HS, Kim BS, Lee IS, Lee S, Yook JH. Intracorporeal laparoscopic Roux-en-Y gastrojejunostomy after 95% gastrectomy for early gastric cancer in the upper third of the stomach: a report on 21 cases. J Laparoendosc Adv Surg Tech A. 2013 Mar;23(3):250-7.
-
9Kitano S, Iso Y, Moriyama M, Sugimachi K. Laparoscopy-assisted Billroth I gastrectomy. Surg Laparosc Endosc. 1994 Apr;4(2):146-8.
-
10Kitano S, Shiraishi N, Uyama I, Sugihara K, Tanigawa N. A multicenter study on oncologic outcome of laparoscopic gastrectomy for early cancer in Japan. Ann Surg. 2007 Jan;245(1):68-72.
-
11Kodera Y, Fujiwara M, Ohashi N, Nakayama G, Koike M, Morita S, et al. Laparoscopic surgery for gastric cancer: a collective review with meta-analysis of randomized trials. J Am Coll Surg. 2010 Nov;211(5):677-86.
-
12Kojima K, Inokuchi M, Kato K, Motoyama K, Sugihara K. Petersen's hernia after laparoscopic distal gastrectomy with Roux-en-Y reconstruction for gastric cancer. Gastric Cancer. 2013 Apr 5.
-
13Marangoni G, Villa F, Shamil E, Botha AJ. OrVil-assisted anastomosis in laparoscopic upper gastrointestinal surgery: friend of the laparoscopic surgeon. Surg Endosc. 2012 Mar;26(3):811-7.
-
14Mingoli A, Sgarzini G, Binda B, Brachini G, Belardi V, Huscher CG, et al. Totally laparoscopic approach for treatment of early and advanced gastric cancer. J Am Coll Surg. 2007 Jan;204(1):187-8.
-
15Orsenigo E, Di Palo S, Tamburini A, Staudacher C. Laparoscopy-assisted gastrectomy versus open gastrectomy for gastric cancer: a monoinstitutional Western center experience. Surg Endosc. 2010 Jan;25(1):140-5.
-
16Shim JH, Yoo HM, Oh SI, Nam MJ, Jeon HM, Park CH, et al. Various types of intracorporeal esophagojejunostomy after laparoscopic total gastrectomy for gastric cancer. Gastric Cancer. 2013 Jul;16(3):420-7.
-
17Sun J, Li J, Wang J, Pan T, Zhou J, Fu X, et al. Meta-analysis of randomized controlled trials on laparoscopic gastrectomy vs. open gastrectomy for distal gastric cancer. Hepatogastroenterology. 2012 Sep;59(118):1699-705.
-
18Vinuela EF, Gonen M, Brennan MF, Coit DG, Strong VE. Laparoscopic versus open distal gastrectomy for gastric cancer: a meta-analysis of randomized controlled trials and high-quality nonrandomized studies. Ann Surg. 2012 Mar;255(3):446-56.
-
19Wang DR, Zhao JG, Yu HF, Wang LH, Jiang GQ, Li YK, et al. [Laparoscopic versus open surgery for D2 gastrectomy in advanced gastric cancer]. Zhonghua Wei Chang Wai Ke Za Zhi. 2012 Sep;15(9):964-6.
Datas de Publicação
-
Publicação nesta coleção
Jan-Mar 2014
Histórico
-
Recebido
18 Out 2013 -
Aceito
05 Dez 2013