Resumo
Rare earth elements supported in zeolites are the most important catalysts in the fluid cracking of petroleum. The solid state ion exchange of Eu3+ in Y zeolite was investigated. First of all, the hydrated EuCl3 was well mixed in a ball mill and was then heated at 300ºC for different times. The quantitative determination of Eu3+ showed that the degree of ion exchange depends on the reaction time at constant temperature, being ~95% in 4 h. The X-ray study showed that the crystallinity of the zeolite is little affected by the exchange procedure. The study of spectroscopic properties of Eu3+, emission spectra and lifetime, give information about the migration and position of the ion in the zeolite cages.
europium; Y zeolites; ion exchange
europium; Y zeolites; ion exchange
TROCA IÔNICA NO ESTADO SÓLIDO DE EURÓPIO3+ EM ZEÓLITA Y: INFLUÊNCIA DO TEMPO DE REAÇÃO
Eduardo J. Nassar* e Osvaldo A. Serra
Departamento de Química - FFCLRP-USP - Av Bandeirantes, 3900 - 14049-901 - Ribeirão Preto - SP
Eduardo F. Souza-Aguiar
EQ/UFRJ - Petrobras/CENPES - Rio de Janeiro - RJ
*E-mail: ejnassar@usp.br
Recebido em 1/7/96; aceito em 8/10/97
IONIC EXCHANGE OF EUROPIUM3+ IN Y ZEOLITE IN THE SOLID STATE: INFLUENCE OF REACTION TIME. Rare earth elements supported in zeolites are the most important catalysts in the fluid cracking of petroleum. The solid state ion exchange of Eu3+ in Y zeolite was investigated. First of all, the hydrated EuCl3 was well mixed in a ball mill and was then heated at 300oC for different times. The quantitative determination of Eu3+ showed that the degree of ion exchange depends on the reaction time at constant temperature, being ~95% in 4 h. The X-ray study showed that the crystallinity of the zeolite is little affected by the exchange procedure. The study of spectroscopic properties of Eu3+, emission spectra and lifetime, give information about the migration and position of the ion in the zeolite cages.
Keywords: europium; Y zeolites; ion exchange.
1. INTRODUÇÃO
As zeólitas são aluminosilicatos naturais ou sintéticos. Elas possuem uma vasta aplicação, principalmente como catalisadores e em particular como componente ativo dos catalisadores de craqueamento de petróleo (FCC). A zeólita sintética do tipo Y tem em sua estrutura, de acordo com Breck1,2, a unidade fundamental sodalita, que é um octaedro truncado constituído de unidades tetraédricas de AlO4 e SiO4. Estes octaedros truncados são interligados através de prismas hexagonais dando origem a vários tipos de cavidades. A rede zeolítica possui uma densidade de carga negativa devido à introdução de Al3+ em sítios de silício IV, sendo neutralizada por prótons, cátions metálicos ou complexos catiônicos2,3. A zeólita Y é sintetizada principalmente na forma sódica (NaY) que devido ao fraco campo eletrostático proporcionado pelos íons sódio, torna-a inativa para algumas reações de craqueamento de petróleo. A ativação da zeólita Y se dá através da troca iônica dos íons sódio por íons polivalentes, principalmente íons lantanídeos trivalentes (Ln3+). Essa troca iônica é convencionalmente efetuada em solução, onde uma suspensão da zeólita Y é misturada a uma solução de lantanídeos. Os íons hidratados sofrem hidrólise, após o tratamento térmico da zeólita, dando origem aos grupos -OH ácidos ou sítios ácidos de Brönsted, que são os responsáveis pela atividade catalítica das zeólitas. Karge et al4 estudaram a troca iônica no estado sólido para vários íons, entre eles o La3+, em diferentes zeólitas, utilizando técnicas como: IR, NMR, TG-DTA, MAS, ESR, etc., no sentido de analisar o grau de troca e a eficiência dos catalisadores preparados através de reações no estado sólido.
Este trabalho tem como objetivo estabelecer condições de troca e obter informações sobre a posição dos íons Eu3+ na zeólita Y, incorporados através de reação no estado sólido seguida de tratamento térmico com diferentes tempos de reação. A confirmação de que a incorporação de Eu3+ ocorreu foi obtida utilizando-se de procedimentos analíticos convencionais. Os espectros de emissão e as medidas de tempo de vida das transições eletrônicas do íon forneceram informações relativas à sua mobilidade através das cavidades zeolíticas e sobre o ambiente estrutural ao seu redor.
2. EXPERIMENTAL
O cloreto de európio III foi preparado a partir do óxido de európio III5. A zeólita Y na forma amoniacal (NH4-Y) foi fornecida pela Petrobras S/A.
Os sólidos cloreto de európio III (10,0 mg de óxido) e a zeólita Y na forma amoniacal (1000,0 mg), foram misturados em um moinho de uma bola Minutem-MLW-KM1, na mais baixa vibração possível, durante 1 hora, equação (1).
 3NH
3NH
(1)
A mistura inicial foi dividida em 5 partes. Estudos preliminares5 indicaram ser a temperatura de300oC a que conduziu a melhores resultados de incorporação do íon lantanídico. Todas as alíquotas foram aquecidas a esta temperatura, sendo variado o tempo de aquecimento. Amostras designadas de 1, 2, 3, 4 e 5, com tempos de aquecimento a 300oC: 1/2, 1, 2, 4, e 8h, respectivamente.
Todas as amostras foram calcinadas na presença de ar em uma mufla EDG FI2.
A reação pode ser descrita pela equação(2):

(2)
Os espectros de luminescência foram obtidos em um espectrofluorímetro SPEX-FLUOROLOG II. Nos espectros de excitação variou-se a radiação incidente de 300 a 400 nm, medindo-se a emissão em 612 nm (lem). Os espectros de emissão foram obtidos utilizando-se o comprimento de onda de excitação de 394 nm (lexc), sendo registrados de 550 a 750 nm; fendas de excitação (fex) 2,0 mm (7,0 nm) e emissão (fem) 0,5 mm (1,0 nm) e tensão na fotomultiplicadora (VFM) de 1000 V. As medidas de tempo de vida foram obtidas no mesmo fluorímetro SPEX, através do acessório de fosforimetria 1934D (lâmpada de Xe pulsada), excitação fixada em 394 nm e a emissão em 612 nm. Antes da excitação e após a emissão foram utilizados filtros Corning7 C-9863 (0,2% de transmitância entre 400 e 700 nm) e C-3384 (0,2% de transmitância abaixo de 420 nm), respectivamente.
A determinação analítica do Eu3+ incorporado na zeólita Y foi efetuada utilizando-se o método descrito por Marczenko8 (método do Arsenazo III), adaptado em nosso laboratório9. A quantidade de Eu3+ que não se incorporou foi eliminada, juntamente com o NH4Cl, mediante a lavagem da zeólita com água destilada por 30 minutos. Os íons de Eu3+ localizados nas supercavidades foram retirados em solução através da troca iônica com Na+ (tratamento com NaCl ~1M). Os íons de Eu3+ que migraram para as cavidades mais internas somente foram determinados após a destruição da zeólita com ácido clorídrico concentrado.
Os difratogramas de raios X foram obtidos em um difratômetro de raios X Universal Modelo XZG-4C, utilizando-se radiação proveniente do cobre (Ka) e filtro de níquel e as condições de 36kV/20mA, varredura em 2q de 2o/minuto. A cristalinidade das amostras foi medida utilizando-se a zeólita Y como padrão10:
3. RESULTADOS E DISCUSSÃO
Na figura 1 está representado o espectro de emissão do íon Eu3+ para a amostra 1 (calcinada a 300oC por 1/2 h). Podemos observar os cinco conjuntos de bandas características do Eu3+, correspondente às transições do estado excitado 5D0 para os estados 7FJ,(J = 0, 1, 2, 3 e 4).
A transição 5D0 ®7F0 é permitida apenas nos grupos de simetria11 Cnv, Cn ou Cs ; a presença da banda correspondente a esta transição nos espectros de emissão do Eu3+ nas zeólitas indica que o sistema emissor pertence a um destes grupos de simetria. A transição entre dois níveis de J = 0, não deve apresentar nenhum desdobramento devido ao efeito do campo cristalino. Qualquer assimetria no contorno desta banda é atribuída à presença de mais de um sítio de Eu3+ emissor. Como podemos observar na figura 1, o contorno da banda 5D0® 7F0 (l = 580 nm) não é simétrico. Isto é um indicativo de que o Eu3+ está ocupando mais de um sítio na estrutura zeolítica. A assimetria desta banda também foi observada para as outras amostras. A banda correspondente à transição 5D0® 7F1 (l = 590 nm) é de natureza puramente dipolo-magnético. A intensidade desta banda é muito pouco afetada pelo ambiente do campo cristalino ao qual está submetido o Eu3+, podendo ser tomada como um padrão interno para a medida das intensidades relativas das outras bandas do espectro11. As intensidades relativas são calculadas em termos de Áreas Relativas (R) sob os picos. A partir dos espectros de emissão foram determinados os parâmetros de intensidade experimental W2 e W4, usando-se as transições 5D0® 7F1,2,4 , conforme os trabalhos de Malta e colaboradores12. Os parâmetros de intensidade W2 e W4 foram calculados a partir das expressões :
A01= coeficiente de emissão expontânea para a transição 5D0 ® 7F1
n = índice de refração da zeólita (sodalita = 1,48 )7
01= média das freqüências da emissão 5D0® 7F1 (baricentro)S01, S02, S04 = Áreas das bandas correspondentes as transições 5D0® 7F1, 2 e 4
W2 = parâmetro de intensidade relativo a transição 5D0® 7F2
W4 = parâmetro de intensidade relativo a transição 5D0® 7F4
A tabela 1 mostra as áreas relativas (R) da transição 5D0® 7F2 em relação a transição 5D0® 7F1, o tempo de vida da transição 5D0® 7F2 e os parâmetros de intensidade W2 e W4 do Eu3+ nas zeólitas em estudo.
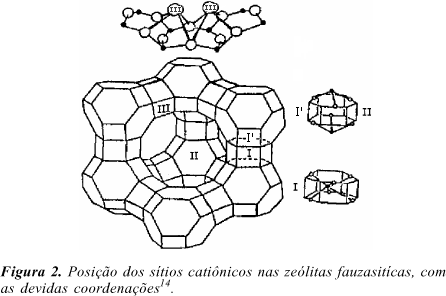
Os dados da tabela 1 não apresentaram mudanças significativas, indicando assim ambientes semelhantes para o íon Eu3+ nas zeólitas. No entanto, para as amostras 4 e 5 o pequeno decréscimo na R21 indica um aumento na simetria ao redor do íon, com a possível migração dos íons para cavidades mais internas, de maior simetria, como por exemplo o sítio I, figura 213.
Os tempos de vida, sem variação significativa (Tabela 1) indicam um mesmo número de moléculas de água e/ou -OH ao redor do Eu3+. Utilizando a fórmula descrita por Horrocks15, n = q[k(H2O) - k(D2O)], q ~ 1 ou 2 para H2O e OH respectivamente, k(D2O) ~ 0,316, obtivemos um número médio de 2 moléculas de água e/ou -OH. O Eu3+ pode estar localizado nos sítios I totalmente coordenado aos oxigênios estruturais, nos sítios I', II e II' coordenado a três moléculas de água e/ou -OH; finalmente, nos sítios III, coordenado a quatro oxigênios estruturais e a duas moléculas de água e/ou -OH. Hazenkamp et al13 utilizando o mesmo método determinaram para a zeólita A dois sítios emissores coordenados a 4 e 2 moléculas de água e/ou -OH.
A figura 3 mostra os resultados da determinação analítica do Eu3+ incorporado na zeólita. Como podemos observar a percentagem de Eu3+ que é trocado na zeólita, (representado pelo círculo), aumenta em função do tempo de reação. Isto pode ser atribuído ao fato de que a 300oC o Eu3+ possui uma certa mobilidade, e migra para as cavidades mais internas. Com isso, para os tempos de 4 e 8 horas obtivemos uma percentagem de incorporação de 95%. Notamos que a percentagem de Eu3+ localizado nas supercavidades (triângulo) aumenta até o tempo de reação de 4 horas e a partir daí sofre um pequeno decréscimo. Isto indica que uma maior quantidade de Eu3+ migrou para as cavidades mais internas. Isto é demonstrado quando observamos no gráfico o aumento da quantidade de Eu3+ localizado nas cavidades mais internas (quadrado), após o tempo de reação de 4 horas.
A cristalinidade da zeólita foi determinada através da difração de raio-X das amostras sólidas. A zeólita Y na forma amoniacal foi considerada como padrão (100% Cristalina). Os resultados da cristalinidade das amostras são mostrados na tabela 2.
Como podemos observar pelos dados da tabela 2, o fato da mistura dos reagentes ter sido feita em um moinho de bola não afetou a cristalinidade, já que a mistura inicial que não foi submetida a aquecimento, apresentou um valor de 99%. Podemos também notar que não houve uma diferença significativa na cristalinidade das amostras com relação ao tempo de aquecimento.
4. CONCLUSÃO
Neste trabalho foi possível comprovar a reação no estado sólido, através da utilização das propriedades espectroscópicas do íon Eu3+. O íon Eu3+ pode estar localizados nos sítios I, I', II, II' III.
A determinação analítica mostrou que as observações feitas através dos espectros de emissão e das medidas de tempo de vida são altamente confiáveis, pois temos íons nas supercavidades (sítios II e III) e cavidades internas (sítios I, I', II').
Concluímos também que a troca iônica no estado sólido possui uma grande eficiência de troca, e que a moagem dos sólidos permitiu uma boa homogeneização dos reagentes sem afetar a cristalinidade da zeólita.
AGRADECIMENTOS
Ao Edson e Ricardo da Faculdade de Odontologia da USP-Ribeirão Preto, pelos difratogramas de raios-X. À Dra. Ieda L. V. Rosa do Departamento de Química da UFSCar e aos Prof. Dr. Gilberto. F. de Sá e Oscar L. Malta do Departamento de Química Fundamental de UFPE, pelas valiosas discussões. A CAPES, CNPq, FINEP, pelas bolsas concedidas e suporte financeiro.
REFERÊNCIAS
1. Breck, D. W.; J. Chem. Educ. 1964, 48, 678.
2. Breck, D. W., Zeolites Molecular Sieves; Structure Chemistry and Use, Wiley, New York, 1974.
3. Mortier, W. J.; Schoonheydt, R. A.; Prog. Sol. St. Chem. 1985, 16, 1.
4. Karge, H. G.; et al, Applied Catalysis 1991, 75, 343.
5. Nassar, E. J.; Dissertação de Mestrado, FFCL de Ribeirão Preto - USP, 1992.
6. Choppin, G. R., in G. R. Choppin and J. -C. G. Bunzli (eds), Lanthanide Probes in Life Chemical and Earth Sciences, Ed. Elsevier, Amsterdam, 1989, chapter 1.
7. CRC "Handbook of Chemistry and Physics" 50th Edition Chemical Rubber Company, Cleveland 1969 - 70, B216.
8. Marczenko, Z., Separation and Spectrophotometric Determination of Elements, John Willey & Sons Eds., London 1986, 468.
9. Rosa, I.L.V. e Serra, O. A.; Quím. Nova 1993, 16, 85.
10. Guerra, S. R., Dissertação de Mestrado, UFRJ, Rio de Janeiro, 1991.
11. Reisfeld, R.; Struct. Bonding 1973, 13, 53.
12. a) de Sá, G. F.; e Silva, F. R. G.; and Malta, O. L.; J. of Alloys and Compounds 1994, 207/208, 457. b)Malta, O. L., dos Santos, M. C. C., Thompson, L. C. and Ito, N. K., J. of Luminescence (no prelo). c) Malta, O. L.; J. Phys. Chem. Solids 1995, 56, 1053. d) de Sá, G. F. e Malta, O. L., comunicação particular.
13. Hazenkamp, M. F., et al; J. Chem. Soc. Faraday Trans. 1992, 88, 141.
14. a) Rosa, I. L. V.; Tese de Doutorado, Instituto de Química da UNESP, Araraquara 1995; b) Pastore, H. O.; Tese de Doutorado; I. Q. Unicamp, Campinas 1991; c) Breck, D. W., In: "Zeolites Molecular Sieves", Willey, New York, 1974.
15. Horrocks, W. de W. Jr. and Sudnick, D. R.; Acc. Chem. Res. 1981, 14, 384.
16. Bunzli, J. -C. G., in G. R. Choppin and J. -C. G. Bunzli (eds), Lanthanide Probes in Life Chemical and Earth Sciences, Ed. Elsevier, Amsterdam, 1989, chapter 7.
- 1. Breck, D. W.; J. Chem. Educ 1964, 48, 678.
- 2. Breck, D. W., Zeolites Molecular Sieves; Structure Chemistry and Use, Wiley, New York, 1974.
- 3. Mortier, W. J.; Schoonheydt, R. A.; Prog. Sol. St. Chem 1985, 16, 1.
- 4. Karge, H. G.; et al, Applied Catalysis 1991, 75, 343.
- 5. Nassar, E. J.; Dissertação de Mestrado, FFCL de Ribeirão Preto - USP, 1992.
- 6. Choppin, G. R., in G. R. Choppin and J. -C. G. Bunzli (eds), Lanthanide Probes in Life Chemical and Earth Sciences, Ed. Elsevier, Amsterdam, 1989, chapter 1.
- 7. CRC "Handbook of Chemistry and Physics" 50th Edition Chemical Rubber Company, Cleveland 1969 - 70, B216.
- 8. Marczenko, Z., Separation and Spectrophotometric Determination of Elements, John Willey & Sons Eds., London 1986, 468.
- 9. Rosa, I.L.V. e Serra, O. A.; Quím. Nova 1993, 16, 85.
- 10. Guerra, S. R., Dissertação de Mestrado, UFRJ, Rio de Janeiro, 1991.
- 11. Reisfeld, R.; Struct. Bonding 1973, 13, 53.
- 12. a) de Sá, G. F.; e Silva, F. R. G.; and Malta, O. L.; J. of Alloys and Compounds 1994, 207/208, 457.
- b)Malta, O. L., dos Santos, M. C. C., Thompson, L. C. and Ito, N. K., J. of Luminescence (no prelo).
- c) Malta, O. L.; J. Phys. Chem. Solids 1995, 56, 1053.
- d) de Sá, G. F. e Malta, O. L., comunicação particular.
- 13. Hazenkamp, M. F., et al; J. Chem. Soc. Faraday Trans 1992, 88, 141.
- 14. a) Rosa, I. L. V.; Tese de Doutorado, Instituto de Química da UNESP, Araraquara 1995;
- b) Pastore, H. O.; Tese de Doutorado; I. Q. Unicamp, Campinas 1991;
- c) Breck, D. W., In: "Zeolites Molecular Sieves", Willey, New York, 1974.
- 15. Horrocks, W. de W. Jr. and Sudnick, D. R.; Acc. Chem. Res 1981, 14, 384.
- 16. Bunzli, J. -C. G., in G. R. Choppin and J. -C. G. Bunzli (eds), Lanthanide Probes in Life Chemical and Earth Sciences, Ed. Elsevier, Amsterdam, 1989, chapter 7.
Datas de Publicação
-
Publicação nesta coleção
28 Nov 2003 -
Data do Fascículo
Abr 1998
Histórico
-
Aceito
08 Out 1997 -
Recebido
01 Jul 1996