DIRETRIZES
V Diretriz Brasileira de Dislipidemias e Prevenção da Aterosclerose
Xavier H. T., Izar M. C., Faria Neto J. R., Assad M. H., Rocha V. Z., Sposito A. C., Fonseca F. A., dos Santos J. E., Santos R. D., Bertolami M. C., Faludi A. A., Martinez T. L. R., Diament J., Guimarães A., Forti N. A., Moriguchi E., Chagas A. C. P., Coelho O. R., Ramires J. A. F.
Correspondência Correspondência: Sociedade Brasileira de Cardiologia Av. Marechal Câmara, 160/330 - Centro Rio de Janeiro - CEP: 20020-907 e-mail: scb-da@cardiol.br
MENSAGEM DOS COORDENADORES
O Departamento de Aterosclerose da SBC, acompanhando o amplo cenário de publicações científicas sobre o tratamento das dislipidemias e prevenção da aterosclerose e a importância do seu impacto sobre o risco cardiovascular, e reconhecendo a necessidade de atualizar a sua última Diretriz, publicada em 2007, reuniu um comitê de especialistas, a partir de junho de 2012, para a elaboração desse documento que ora apresentamos à comunidade médica.
São diversos os ensaios clínicos e as metanálises que demonstram, de maneira inequívoca, que o controle das dislipidemias, em especial as reduções mais intensivas do LDL-C, têm se associado a importantes benefícios na redução de eventos e mortalidade cardiovascular. Dessa forma, a importância da estratificação do risco individual, a necessidade do tratamento mais eficaz, e o alcance da meta terapêutica preconizada com a maior brevidade, devem ser reconhecidos e adotados na boa prática médica.
Reconhecemos que desafios importantes se colocam como obstáculos ao tratamento otimizado do colesterol: do diagnóstico correto das dislipidemias ao custo do seu tratamento, envolvem, sobretudo, a relação médico-paciente, onde a inércia terapêutica e a falta de adesão, dificultam que a grande maioria dos pacientes sejam contemplados com os benefícios já comprovados.
É nesse panorama, que a V Diretriz Brasileira de Dislipidemias e Prevenção da Aterosclerose pretende inserir-se, como ferramenta útil, instrumento da prática clínica diária. Desejamos que as recomendações desse documento ganhem repercussão nacional, garantindo tanto aos médicos como a seus pacientes, o melhor tratamento e os benefícios da redução do risco cardiovascular.
Os Coordenadores.
EVIDÊNCIAS CIENTÍFICAS QUE IMPACTAM A PRÁTICA CLÍNICA
As evidências científicas que determinam mudanças na prática clínica devem ser baseadas nos desfechos de saúde-doença, como morte e incidência de doença. Dados de pesquisas que interferem em desfechos substitutos (marcadores fisiopatológicos, bioquímicos etc.) têm menor impacto direto na prática clínica, embora possam ser relevantes para melhor compreensão da doença e desenvolvimento de metodologias diagnósticas e terapêuticas.
Hierarquia das evidências
Para situar o leitor sobre a consistência das recomendações dessa Diretriz, o grau de recomendação e os níveis de evidência foram baseados nos parâmetros descritos na Tabela I.
METABOLISMO LIPÍDICO
Aspectos gerais
Dos pontos de vista fisiológico e clínico, os lípides biologicamente mais relevantes são os fosfolípides, o colesterol, os triglicérides (TG) e os ácidos graxos (AG). Os fosfolípides formam a estrutura básica das membranas celulares. O colesterol é precursor dos hormônios esteroidais, dos ácidos biliares e da vitamina D. Além disso, como constituinte das membranas celulares, o colesterol atua na fluidez destas e na ativação de enzimas aí situadas. Os TGs são formados a partir de três ácidos graxos ligados a uma molécula de glicerol e constituem uma das formas de armazenamento energético mais importantes no organismo, depositados nos tecidos adiposo e muscular.
Os ácidos graxos podem ser classificados como saturados (sem duplas ligações entre seus átomos de carbono), mono ou poli-insaturados, de acordo com o número de ligações duplas na sua cadeia. Os AGs saturados mais frequentemente presentes em nossa alimentação são: láurico, mirístico, palmítico e esteárico (que variam de 12 a 18 átomos de carbono). Entre os AGs monoinsaturados, o mais frequente é o ácido oléico, que contém 18 átomos de carbono. Quanto aos AGs poli-insaturados, podem ser classificados como ômega-3 (eicosapentaenoico, docosaexanoico e linolênico), ou ômega-6 (linoleico), de acordo com a presença da primeira dupla ligação entre os carbonos, a partir do grupo hidroxila.
Lipoproteínas - estrutura e função
As lipoproteínas permitem a solubilização e o transporte dos lípides, que são substâncias geralmente hidrofóbicas, no meio aquoso plasmático. São compostas por lípides e proteínas denominadas apolipoproteínas (apos). As apos têm diversas funções no metabolismo das lipoproteínas, como a formação intracelular das partículas lipoproteicas, caso das apos B100 e B48, e a atuação como ligantes a receptores de membrana, como as apos B100 e E, ou cofatores enzimáticos, como as apos CII, CIII e AI.
Existem quatro grandes classes de lipoproteínas separadas em dois grupos: (1) as ricas em TG, maiores e menos densas, representadas pelos quilomícrons, de origem intestinal, e pelas lipoproteínas de densidade muito baixa ou very low density lipoprotein (VLDL), de origem hepática; e (2) as ricas em colesterol, incluindo as de densidade baixa ou low density lipoprotein (LDL) e as de densidade alta ou high density lipoprotein (HDL). Existe ainda uma classe de lipoproteínas de densidade intermediária ou intermediary density lipoprotein (IDL) e a lipoproteína (a) [Lp(a)], que resulta da ligação covalente de uma partícula de LDL à apo (a). A função fisiológica da Lp(a) não é conhecida, mas, em estudos mecanísticos e observacionais, ela tem sido associada a formação e progressão da placa aterosclerótica.
Metabolismo das lipoproteínas
Via intestinal
Os TGs representam a maior parte das gorduras ingeridas. Após a ingestão, as lipases pancreáticas hidrolisam os TGs em AGs livres, monoglicerídeos e diglicerídeos. Sais biliares liberados na luz intestinal emulsificam esses e outros lípides oriundos da dieta e circulação entero-hepática, com formação de micelas. A solubilização dos lípides sob a forma de micelas facilita sua movimentação pela borda em escova das células intestinais. A proteína Niemann-Pick C1-like 1 (NPC1-L1), parte de um transportador de colesterol intestinal, está situada na membrana apical do enterócito e promove a passagem do colesterol pela borda em escova dessa célula, facilitando a absorção intestinal do colesterol1. A inibição da proteína NPC1-L1, com consequente inibição seletiva da absorção do colesterol, vem sendo reconhecida como importante alvo terapêutico no tratamento da hipercolesterolemia.
Após serem absorvidas pelas células intestinais, as diversas partículas lipídicas, particularmente os AGs, são utilizadas na produção de quilomícrons, que também contêm apo B48, o componente aminoterminal da apo B100. Os quilomícrons são em seguida secretados pelas células intestinais para o interior do sistema linfático, de onde alcançam a circulação pelo ducto torácico. Enquanto circulam, os quilomícrons sofrem hidrólise pela lipase lipoproteica, enzima localizada na superfície endotelial de capilares do tecido adiposo e músculos, com a liberação de AG e glicerol do core, e de colesterol não esterificado da superfície dessas partículas. Após esse processo de lipólise, AGs são capturados por células musculares e também adipócitos, esses últimos importantes reservatórios de TG elaborados a partir de AG. Remanescentes de quilomícrons e AG também são capturados pelo fígado, onde são utilizados na formação de VLDL.
Via hepática
O transporte de lípides de origem hepática ocorre por meio das VLDL, IDL e LDL. As VLDL são lipoproteínas ricas em TG e contêm a apo B100 como sua apolipoproteína principal. As VLDLs são montadas e secretadas pelo fígado e liberadas na circulação periférica. A montagem das partículas de VLDL no fígado requer a ação de uma proteína intracelular, a proteína de transferência de triglicérides microssomal ou microsomal triglyceride transfer protein (MTP), responsável pela transferência dos TGs para a apo B, permitindo a formação da VLDL. A montagem hepática da VLDL também vem sendo reconhecida como foco terapêutico no tratamento da hipercolesterolemia, seja por meio da inibição da síntese de apo B2, seja pela inibição da MTP3. Na circulação, os TGs das VLDL, assim como no caso dos quilomícrons, são então hidrolisados pela lipase lipoproteica, enzima estimulada pela apo CII e inibida pela apo CIII. Os AGs assim liberados são redistribuídos para os tecidos, onde podem ser armazenados, como no tecido adiposo, ou prontamente utilizados, como nos músculos esqueléticos. Por ação da lipase lipoproteica, as VLDLs, progressivamente depletadas de TG, transformam-se em remanescentes, também removidos pelo fígado por receptores específicos. Uma parte das VLDLs dá origem às IDLs, que são removidas rapidamente do plasma. O processo de catabolismo continua, envolvendo a ação da lipase hepática e resultando na formação das LDLs.
Durante a hidrólise das VLDLs, essas lipoproteínas também estão sujeitas a trocas lipídicas com as HDLs e LDLs. Por intermédio da ação da proteína de proteína de transferência do éster de colesterol ou cholesterol ester transfer protein (CETP), as VLDLs trocam TGs por ésteres de colesterol com as HDLs e LDLs. A CETP vem sendo testada como alvo terapêutico no tratamento de dislipidemias, em particular no tratamento da HDL baixa, e na redução do risco cardiovascular (CV)4.
Lipoproteína de baixa densidade
A LDL tem conteúdo apenas residual de TG e é composta principalmente de colesterol e uma única apolipoproteína, a apo B100. As LDLs são capturadas por células hepáticas ou periféricas por meio dos receptores de LDL (LDL-R). No interior das células, o colesterol livre pode ser esterificado para depósito por ação da enzima acil-CoA:colesteril aciltransferase (ACAT).
A expressão dos LDL-Rs nos hepatócitos é a principal responsável pelo nível de colesterol no sangue e depende da atividade da enzima hidroximetilglutaril (HMG) CoA redutase, enzima-chave para a síntese intracelular do colesterol hepático. A inibição da HMG-CoA redutase e, portanto, da síntese intracelular do colesterol, é importante alvo terapêutico no tratamento da hipercolesterolemia. Com a queda do conteúdo intracelular do colesterol, ocorre aumento da expressão de LDL-R nos hepatócitos, e, assim, maior captura de LDL, IDL e VLDL circulantes por essas células.
Recentemente, a identificação e a caracterização da proproteína convertase subtilisina/kexina tipo 9 (PCSK9) introduziram novos conhecimentos ao metabolismo do colesterol. A PCSK9 é uma protease expressa predominantemente pelo fígado, intestino e rins5, capaz de inibir a reciclagem do LDL-R de volta à superfície celular, resultando em menor número de receptores e aumento dos níveis plasmáticos de LDL. A inibição da PCSK9, outro potencial foco na terapêutica da hipercolesterolemia, bloqueia a degradação do LDL-R, aumentando a remoção da LDL circulante6.
Lipoproteína de alta densidade
As partículas de HDL são formadas no fígado, no intestino e na circulação e seu principal conteúdo proteico é representado pelas apos AI e AII. O colesterol livre da HDL, recebido das membranas celulares, é esterificado por ação da lecitina-colesterolaciltransferase (LCAT). A apo AI, principal proteína da HDL, é cofator dessa enzima. O processo de esterificação do colesterol, que ocorre principalmente nas HDLs, é fundamental para sua estabilização e transporte no plasma, no centro desta partícula. A HDL transporta o colesterol até o fígado, onde este é captado pelos receptores SR-B1. O circuito de transporte do colesterol dos tecidos periféricos para o fígado é denominado transporte reverso do colesterol. Neste transporte, é importante a ação do complexo ATP binding cassete A1 (ABC-A1), que facilita a extração do colesterol da célula pelas HDLs. A HDL também tem outras ações que contribuem para a proteção do leito vascular contra a aterogênese, como a remoção de lípides oxidados da LDL, a inibição da fixação de moléculas de adesão e monócitos ao endotélio e a estimulação da liberação de óxido nítrico. Além das diferenças em tamanho, densidade e composição química, as lipoproteínas podem diferir entre si pela modificação in vivo por oxidação, glicação ou dessialização. Estas modificações influenciam seu papel no metabolismo lipídico e no processo aterogênico.
Bases fisiopatológicas das dislipidemias primárias
O acúmulo de quilomícrons e/ou de VLDL no compartimento plasmático resulta em hipertrigliceridemia e decorre da diminuição da hidrólise dos TGs destas lipoproteínas pela lipase lipoproteica ou do aumento da síntese de VLDL. Variantes genéticas das enzimas ou apolipoproteínas relacionadas com estas lipoproteínas podem causar ambas as alterações metabólicas, aumento de síntese ou redução da hidrólise. O acúmulo de lipoproteínas ricas em colesterol como a LDL no compartimento plasmático resulta em hipercolesterolemia. Este acúmulo pode ocorrer por doenças monogênicas, em particular por defeito no gene do LDL-R ou no gene da apo B100. Centenas de mutações do LDL-R já foram detectadas em portadores de hipercolesterolemia familiar (HF), algumas causando redução de sua expressão na membrana; outras, deformações na sua estrutura e função. Mutação no gene que codifica a apo B100 pode também causar hipercolesterolemia por meio da deficiência no acoplamento da LDL ao receptor celular. Mais comumente, a hipercolesterolemia resulta de mutações em múltiplos genes envolvidos no metabolismo lipídico, as hipercolesterolemias poligênicas. Nestes casos, a interação entre fatores genéticos e ambientais determina o fenótipo do perfil lipídico.
ATEROGÊNESE
A aterosclerose é uma doença inflamatória crônica de origem multifatorial que ocorre em resposta à agressão endotelial, acometendo principalmente a camada íntima de artérias de médio e grande calibres7. A formação da placa aterosclerótica inicia-se com a agressão ao endotélio vascular devida a diversos fatores de risco como dislipidemia, hipertensão arterial ou tabagismo. Como consequência, a disfunção endotelial aumenta a permeabilidade da íntima às lipoproteínas plasmáticas, favorecendo a retenção das mesmas no espaço subendotelial. Retidas, as partículas de LDL sofrem oxidação, causando a exposição de diversos neoepitopos e tornando-as imunogênicas. O depósito de lipoproteínas na parede arterial, processo-chave no início da aterogênese, ocorre de maneira proporcional à concentração dessas lipoproteínas no plasma. Além do aumento da permeabilidade às lipoproteínas, outra manifestação da disfunção endotelial é o surgimento de moléculas de adesão leucocitária na superfície endotelial, processo estimulado pela presença de LDL oxidada (LDL-ox). As moléculas de adesão são responsáveis pela atração de monócitos e linfócitos para a intimidade da parede arterial. Induzidos por proteínas quimiotáticas, os monócitos migram para o espaço subendotelial, onde se diferenciam em macrófagos, que por sua vez captam as LDL-ox, sem controle da quantidade recebida. Os macrófagos repletos de lípides são chamados de células espumosas e são o principal componente das estrias gordurosas, lesões macroscópicas iniciais da aterosclerose. Uma vez ativados, os macrófagos são, em grande parte, responsáveis pela progressão da placa aterosclerótica mediante a secreção de citocinas, que amplificam a inflamação, e de enzimas proteolíticas, capazes de degradar colágeno e outros componentes teciduais locais. Outras células inflamatórias também participam do processo aterosclerótico. Os linfócitos T, embora menos numerosos que os macrófagos no interior do ateroma, são de grande importância na aterogênese. Mediante interação com os macrófagos, por exemplo, as células T podem se diferenciar e produzir citocinas que modulam o processo inflamatório local8.
Alguns mediadores da inflamação estimulam a migração e proliferação das células musculares lisas da camada média arterial. Estas, ao migrarem para a íntima, passam a produzir não só citocinas e fatores de crescimento, mas também matriz extracelular, que formará parte da capa fibrosa da placa aterosclerótica. A placa aterosclerótica plenamente desenvolvida é constituída por elementos celulares, componentes da matriz extracelular e núcleo lipídico e necrótico, formado principalmente por debris de células mortas. As placas estáveis caracterizam-se por predomínio de colágeno, organizado em capa fibrosa espessa, escassas células inflamatórias e núcleo lipídico e necrótico de proporções menores. As instáveis apresentam atividade inflamatória intensa, especialmente nas suas bordas laterais, com grande atividade proteolítica, núcleo lipídico e necrótico proeminente e capa fibrótica tênue9. A ruptura desta capa expõe material lipídico altamente trombogênico, levando à formação de um trombo sobrejacente. Este processo, também conhecido por aterotrombose, é um dos principais determinantes das manifestações clínicas da aterosclerose.
AVALIAÇÃO LABORATORIAL DOS PARÂMETROS LIPÍDICOS E DAS APOLIPOPROTEÍNAS
A coleta de sangue deverá ser realizada após jejum de 12 horas para análise das concentrações de TG, como também para o cálculo do colesterol da LDL (LDL-C) pela fórmula de Friedewald. As determinações do colesterol total (CT), apo B, apo A-I e colesterol da HDL (HDL-C) podem ser analisadas em amostras coletadas sem jejum prévio. O jejum é também importante para avaliar a glicemia. A determinação do perfil lipídico deve ser feita em indivíduos com dieta habitual, estado metabólico e peso estáveis por pelo menos duas semanas antes da realização do exame. Além disso, devem-se evitar ingestão de álcool e atividade física vigorosa nas 72 e 24 horas que antecedem a coleta de sangue, respectivamente.
Variação intraindividual
Existe considerável variação intraindividual nos lipídios plasmáticos. Tem sido descrita variação de 5% a 10% para o CT e superior a 20% para os TGs, particularmente nos indivíduos que apresentam hipertrigliceridemia. Esta variação é de certa forma devida à variação analítica, mas também decorre de fatores ambientais como dieta, atividade física e variação sazonal, com níveis mais elevados de CT e HDL-C durante os meses de frio.
Análise dos lípides e lipoproteínas
A maioria dos estudos que avaliaram o impacto do tratamento sobre o risco CV e estudos com fármacos se baseou na análise do CT e do LDL-C, sendo que o benefício clínico da utilização de outras medidas, entre as quais a apo B, o colesterol não-HDL e várias relações, embora, por vezes, lógico, não foi ainda estabelecido na prática. Portanto as medidas tradicionais de risco CV, como CT e LDL-C, são mantidas e corroboradas por evidências de numerosos estudos, constituindo-se no principal alvo terapêutico na prevenção da doença CV. Os valores referenciais do perfil lipídico são apresentados na Tabela II.
Colesterol total
A avaliação do CT com a finalidade de mensurar o risco CV é recomendada pelos programas de rastreamento populacional, todavia este método pode fornecer dados enganosos em algumas situações. Isto ocorre especialmente em mulheres que frequentemente apresentam níveis elevados de HDL-C e indivíduos com diabetes ou síndrome metabólica, que muitas vezes evoluem com níveis baixos de HDL-C. Para avaliação adequada do risco CV são imperativas as análises do HDL-C e do LDL-C.
Colesterol da lipoproteína de baixa densidade
Na maioria dos estudos clínicos o LDL-C tem sido calculado pela fórmula de Friedewald: LDL-C = CT - (HDL-C + TG/5); onde TG/5 representa o colesterol ligado à VLDL ou VLDL-C.
O valor calculado do LDL-C é baseado em uma série de pressupostos: (1) erros metodológicos podem se acumular, pois a fórmula exige três análises separadas, ou seja, CT, TG e HDL-C; (2) presume-se proporção constante de colesterol e triglicérides nas partículas de VLDL − com valores de TG > 400 mg/dl a fórmula não pode ser usada; (3) o uso da fórmula de Friedewald não é indicado quando o sangue é obtido sem jejum (recomendação III, evidência C) − nestas condições, o colesterol não-HDL pode ser determinado. Apesar dessas limitações, o LDL-C calculado pela fórmula de Friedewald é ainda amplamente utilizado na prática clínica.
Existem vários métodos comercialmente disponíveis para a determinação direta do LDL-C, entretanto certo grau de variabilidade ainda persiste nessa metodologia. Os métodos diretos para determinação de LDL-C poderão ser usados quando o cálculo pela fórmula de Friedewald não for possível.
A fração colesterol não-HDL ou a determinação da apo B pode fornecer melhor estimativa da concentração de partículas aterogênicas, especialmente em pacientes de alto risco portadores de diabetes e/ou síndrome metabólica.
Colesterol não-HDL
A fração colesterol não-HDL é usada como estimativa do número total de partículas aterogênicas no plasma (VLDL + IDL + LDL) e refere-se também a níveis de apo B. O colesterol não-HDL é calculado facilmente pela subtração do HDL-C do CT: Colesterol não-HDL = CT - HDL-C.
O colesterol não-HDL pode fornecer melhor estimativa do risco em comparação com o LDL-C, principalmente nos casos de hipertrigliceridemia associada ao diabetes, à síndrome metabólica ou à doença renal.
Colesterol da lipoproteína de alta densidade
Existem várias técnicas disponíveis e de alta qualidade, mas o método usado deve ser comparado com os métodos de referência disponíveis e controlados por programas internacionais de qualidade.
Triglicérides
A dosagem de TG é determinada por técnica enzimática, um método preciso e barato. Níveis elevados de TG se associam frequentemente a baixos níveis de HDL-C e altos níveis de partículas de LDL pequenas e densas. Recentemente foram publicados estudos sugerindo que a análise da trigliceridemia sem jejum poderia fornecer informações importantes sobre lipoproteínas remanescentes associadas a risco aumentado de doença coronariana. Como isso deve ser utilizado na prática clínica ainda está sob investigação.
Apolipoproteínas
Do ponto de vista técnico, há vantagens na determinação das apo B e da apo A-I. São bons métodos imunoquímicos e de fácil análise em aparelho convencional. O desempenho analítico é bom e tem a facilidade de o método não necessitar de jejum, não sendo sensível a níveis moderadamente elevados de triglicérides.
A apo B é a principal apoproteína das partículas aterogênicas constituídas pelas lipoproteínas VLDL, IDL e LDL. A concentração da apo B é uma boa estimativa do número dessas partículas no sangue. Isto é particularmente importante na presença de LDLs pequenas e densas. Vários estudos clínicos prospectivos têm demonstrado que a apo B é igual ao LDL-C na predição de risco. A apo B ainda não foi avaliada até o momento como alvo de tratamento primário nos estudos com estatinas, mas diversas análises post-hoc desses estudos sugerem que ela pode ser não só um marcador de risco, mas também um alvo de tratamento melhor do que o LDL-C. As principais desvantagens da medida da apo B são: não está incluída nos algoritmos de cálculo de risco cardiovascular e não tem alvo de tratamento predefinido.
A apo A-I é a principal apoproteína da HDL e fornece uma boa estimativa da concentração de HDL-C. Cada partícula de HDL pode transportar várias moléculas de apo A-I. Concentrações plasmáticas de apo A-I < 120 mg/dl para homens e < 140 mg/dl para mulheres correspondem aproximadamente às que são consideradas baixas concentrações de HDL-C.
As relações apo B/apo A-I, CT/HDL-C e colesterol não-HDL/HDL-C fornecem informações semelhantes. A relação entre as apos B e A-I tem sido usada nos grandes estudos prospectivos como indicadora de risco. Essas relações entre lipoproteínas aterogênicas e antiaterogênicas podem ser úteis para a estimativa do risco CV, mas não o são para o diagnóstico das dislipidemias ou como alvos de tratamento.
Lipoproteína (a)
A Lp(a), conforme sugerido por vários estudos, é um marcador de risco adicional de doença arterial coronariana (DAC). O nível plasmático de Lp(a) é, em grande parte, determinado geneticamente. Existem vários métodos para determinação da Lp(a), mas ainda se faz necessária a sua padronização. Sua análise não é recomendada na rotina para avaliar risco CV na população, no entanto a sua determinação pode ser considerada em pessoas com alto risco para doença CV ou com forte história familiar de doença prematura aterotrombótica, como na HF.
Tamanho das partículas de lipoproteínas
As lipoproteínas constituem uma classe heterogênea de partículas e numerosas evidências sugerem que as diferentes subclasses de LDL e HDL apresentam diferentes riscos para aterosclerose. Determinação da LDL pequena e densa pode ser considerada um fator de risco emergente que talvez possa ser usado no futuro, mas não é atualmente recomendada para estimativa de risco CV.
Genotipagem
Diversos genes têm sido associados a doenças cardiovasculares. Neste momento o uso de genotipagem para estimativa de risco não é recomendado. No entanto estudos sugerem que, no futuro, ela poderá ser utilizada para a identificação de indivíduos de alto risco. No diagnóstico de algumas hiperlipidemias geneticamente determinadas, a genotipagem da apolipoproteína E (apo E) e/ou de genes associados à HF pode ser considerada. A apo E está presente em três isoformas (apo E2, E3 e E4), e a sua genotipagem é usada principalmente para o diagnóstico de disbetalipoproteinemia familiar (homozigoto para apo E2), sendo indicada para os casos de hiperlipidemia combinada grave. Ferramentas de rastreamento genético em famílias com HF já estão disponíveis e devem ser usadas em clínicas especializadas.
CLASSIFICAÇÃO DAS DISLIPIDEMIAS11
As dislipidemias primárias ou sem causa aparente podem ser classificadas genotipicamente ou fenotipicamente por meio de análises bioquímicas. Na classificação genotípica, as dislipidemias se dividem em monogênicas, causadas por mutações em um só gene, e poligênicas, causadas por associações de múltiplas mutações que isoladamente não seriam de grande repercussão. A classificação fenotípica ou bioquímica considera os valores de CT, LDL-C, TG e HDL-C e compreende quatro tipos principais bem definidos:
a) hipercolesterolemia isolada: elevação isolada do LDL-C (> 160 mg/dl);
b) hipertrigliceridemia isolada: elevação isolada dos TGs (> 150 mg/dl) que reflete o aumento do número e/ou do volume de partículas ricas em TG, como VLDL, IDL e quilomícrons. Como observado, a estimativa do volume das lipoproteínas aterogênicas pelo LDL-C torna-se menos precisa à medida que aumentam os níveis plasmáticos de lipoproteínas ricas em TG. Portanto, nestas situações, o valor do colesterol não-HDL pode ser usado como indicador de diagnóstico e meta terapêutica;
c) hiperlipidemia mista: valores aumentados de LDL-C (> 160 mg/dl) e TG (> 150 mg/dl). Nesta situação, o colesterol não-HDL também poderá ser usado como indicador e meta terapêutica. Nos casos em que TGs > 400 mg/dl, o cálculo do LDL-C pela fórmula de Friedewald é inadequado, devendo-se, então, considerar a hiperlipidemia mista quando CT > 200 mg/dl;
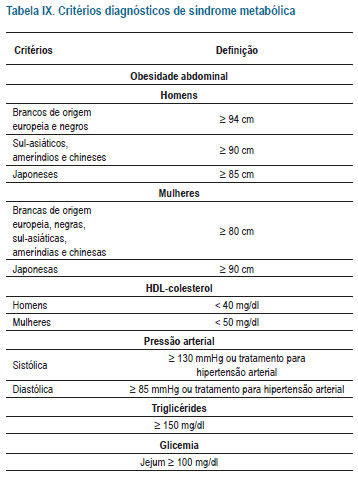
d) HDL-C baixo: redução do HDL-C (homens < 40 mg/dl e mulheres < 50 mg/dl) isolada ou em associação a aumento de LDL-C ou de TG.
ESTRATIFICAÇÃO DO RISCO CARDIOVASCULAR PARA PREVENÇÃO E TRATAMENTO DA ATEROSCLEROSE
Um evento coronário agudo é a primeira manifestação da doença aterosclerótica em pelo menos metade dos indivíduos que apresentam essa complicação. Desta forma, a identificação dos indivíduos assintomáticos que estão mais predispostos é crucial para a prevenção efetiva com a correta definição das metas terapêuticas individuais12. A estimativa do risco de doença aterosclerótica resulta da somatória do risco associado a cada um dos fatores de risco mais a potenciação causada por sinergismos entre alguns desses fatores. Diante da complexidade destas interações, a atribuição intuitiva do risco frequentemente resulta em subestimação ou superestimação dos casos de maior ou menor risco, respectivamente. Para contornar esta dificuldade, diversos algoritmos têm sido criados com base em análises de regressão de estudos populacionais, por meio dos quais a identificação do risco global é aprimorada substancialmente.
Entre os algoritmos existentes, o Escore de Risco de Framingham12,13, o Escore de Risco de Reynolds14,15 − que inclui a proteína C-reativa e o antecedente familiar de doença coronariana prematura, o Escore de Risco Global16 e o Escore de Risco pelo Tempo de Vida17-19 são as opções de escores de risco (ER) que serão discutidas nesse documento.
O ER de Framingham estima a probabilidade de ocorrer infarto do miocárdio ou morte por doença coronariana no período de 10 anos em indivíduos sem diagnóstico prévio de aterosclerose clínica. Embora esta estimativa de risco seja sujeita a correções conforme indicadores epidemiológicos da população estudada, o ER de Framingham identifica adequadamente indivíduos de alto e baixo riscos; o ER de Reynolds estima a probabilidade de infarto do miocárdio, acidente vascular encefálico (AVE), morte e revascularização do miocárdio em 10 anos; o ER Global estima o risco de infarto do miocárdio, AVE, insuficiência vascular periférica ou insuficiência cardíaca em 10 anos. Já o ER pelo Tempo de Vida, utilizado a partir dos 45 anos, avalia a probabilidade de um indivíduo a partir dessa idade apresentar um evento isquêmico. A combinação de um escore de curto prazo com outro de longo prazo permite melhor estimativa de risco.
Esse documento adota o ER Global, para avaliação do risco em 10 anos, e o ER pelo Tempo de Vida como opção para os indivíduos acima de 45 anos considerados de baixo risco ou risco intermediário em 10 anos. Justifica-se o emprego de um escore de curto prazo e outro de longo prazo pelo fato de grande parte das mulheres e dos homens adultos jovens se encontrar na categoria de baixo risco predito em curto prazo, sendo que, em longo prazo, parte destes continuará em baixo risco, enquanto outra parte será reclassificada como de alto risco predito ao longo da vida. Assim, a abordagem do risco pelo tempo de vida pode ser usada para melhorar a motivação de indivíduos com baixo risco predito em curto prazo, mas com alto risco predito em longo prazo, a intensificar as mudanças de estilo de vida e o controle de fatores de risco.
O cálculo do ER pelo Tempo de Vida considera que um indivíduo, aos 45 anos de idade, deva pertencer exclusivamente a uma das seguintes categorias: a) aqueles sem fatores de risco, ou com todos os fatores de risco em controle ótimo; b) os que possuem um ou mais fatores de risco em controle não ótimo; c) aqueles com um ou mais fatores de risco elevados; d) com um dos principais fatores de risco; e) aqueles com dois ou mais dos principais fatores de risco.
Estratificação de risco por etapas
Esta Diretriz recomenda três etapas para a estratificação do risco: (1) a determinação da presença de doença aterosclerótica significativa ou de seus equivalentes; (2) a utilização dos escores de predição do risco; e (3) a reclassificação do risco predito pela presença de fatores agravantes do risco. Cada etapa será discutida a seguir.
Fase 1 - Presença de doença aterosclerótica significativa ou de seus equivalentes
O risco de doença aterosclerótica é estimado com base na análise conjunta de características que aumentam a chance de um indivíduo desenvolver a doença, portanto o mais claro identificador de risco é a manifestação prévia da própria doença. Dessa forma, o primeiro passo na estratificação do risco é a identificação de manifestações clínicas da doença aterosclerótica ou de seus equivalentes, como a presença de diabetes melito tipo 1 ou 2, de doença renal crônica ou de aterosclerose na forma subclínica documentada por metodologia diagnóstica, mesmo em prevenção primária20. Indivíduos assim identificados, homens e mulheres, possuem risco superior a 20% em 10 anos de apresentar novos eventos cardiovasculares (recomendação I, evidência A), ou de um primeiro evento cardiovascular (recomendação I, evidência A).
O paciente que se enquadrar em uma dessas categorias não requer outras etapas para estratificação de risco, sendo considerado automaticamente de ALTO RISCO.
São condições de alto risco as apresentadas na Tabela III.
Fase 2 - Escore de risco
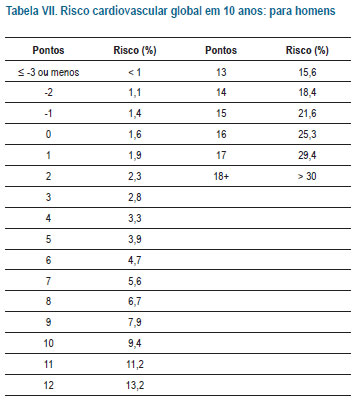
O ER Global (Tabelas IV a VII) deve ser utilizado na avaliação inicial entre os indivíduos que não foram enquadrados nas condições de alto risco apresentadas na Tabela III.
São considerados de BAIXO RISCO por esta Diretriz aqueles com probabilidade < 5% de apresentarem os principais eventos cardiovasculares (DAC, AVE, doença arterial obstrutiva periférica ou insuficiência cardíaca) em 10 anos (recomendação I, evidência A). Os pacientes classificados nessa categoria e que apresentem histórico familiar de doença cardiovascular prematura serão reclassificados para risco intermediário (recomendação IIa, evidência B).
São considerados de risco INTERMEDIÁRIO homens com risco calculado > 5% e < 20% e mulheres com risco calculado > 5% e < 10% de ocorrência de algum dos eventos citados (recomendação I, evidência A)23.
São considerados de ALTO RISCO aqueles com risco calculado > 20% para homens e > 10% para mulheres no período de 10 anos (recomendação I, evidência A)10.
Fase 3 - Fatores agravantes
Nos indivíduos de risco intermediário devem-se utilizar os fatores agravantes (Tabela VIII), que, quando presentes (pelo menos um desses fatores), reclassificam o indivíduo para a condição de alto risco (recomendação IIa, evidência B)11.
Com as três etapas chega-se a um risco absoluto final, conforme apresentado na Tabela X.
Visando reduzir a carga da doença cardiovascular, tem-se enfatizado o cálculo do risco global em 10 anos. No entanto observa-se que grande parte dos indivíduos que são considerados de baixo risco em 10 anos é, na verdade, de alto risco ao longo do tempo de vida. A estimativa do risco de doença cardiovascular pelo tempo de vida permite estratificar de forma mais abrangente a carga de doença cardiovascular na população geral, no momento e no futuro, pois leva em conta o risco de doença cardiovascular enquanto o indivíduo envelhece. Essa ferramenta pode auxiliar em políticas públicas de saúde, permitindo projeções da carga de doença cardiovascular global na população. Esta Diretriz recomenda o uso do ER pelo Tempo de Vida em indivíduos de baixo risco e de risco intermediário a partir dos 45 anos (recomendação IIa, evidência B).
A Tabela XI classifica os fatores de risco de acordo com o controle e/ou importância dos mesmos em ótimos, não ótimos, elevados e principais. As Tabelas XII e XIII mostram o cálculo do ER pelo Tempo de Vida para homens e mulheres, respectivamente, a partir dos 45 anos, com base na exposição a esses fatores ao longo da vida.

O risco predito pelo ER pelo Tempo de Vida > 39% em homens ou > 20,2% em mulheres caracteriza condição de alto risco pelo tempo de vida.
O algoritmo da Figura I resume e auxilia na estratificação do risco CV.
Metas terapêuticas
A mortalidade por DAC é a principal causa de morte no país e o colesterol elevado possui evidências para ser considerado o principal fator de risco modificável com base em estudos tipo caso-controle, observacionais, de base genética ou de tratamento27-30. Torna-se lógico, então, que reduções de colesterol, principalmente nos níveis de LDL-C, por meio de mudanças no estilo de vida e/ou fármacos, ao longo da vida, tenham grande benefício na redução de desfechos CV (recomendação I, evidência A).
Embora o AVC não apresente a mesma relação epidemiológica com o colesterol sérico, como na DAC, o uso de estatinas por diversos mecanismos também determina redução de sua incidência. Os mecanismos envolvidos incluem discreta redução na pressão arterial (PA), aumento de mobilização de células endoteliais progenitoras, redução do risco trombótico, melhora da função endotelial, diminuição da inflamação e maior estabilização de placas vulneráveis31.
Com base na estratificação de risco global proposta, esta Diretriz recomenda, para os indivíduos classificados em RISCO ALTO, INTERMEDIÀRIO ou BAIXO, metas terapêuticas, primárias e secundárias. A meta primária é direcionada para o LDL-C (recomendação I, evidência A) e a meta secundária, para o colesterol não-HDL (recomendação II, evidência A) (Tabela XIV).
Não são propostas metas para o HDL-C, embora se reconheça seu valor como fator de risco CV (recomendação I, evidência A).
Com relação ao TG, a Diretriz considera que pacientes com valores > 500 mg/dl devem receber terapia apropriada para redução do risco de pancreatite, e aqueles com valores entre 150 e 499 mg/dl recebam terapia individualizada, com base no risco CV e condições associadas (recomendação II, evidência A).
Para outras variáveis, como níveis de apolipoproteínas ou para a Lp(a), também não são especificadas metas terapêuticas, embora se reconheça que apo B32,33 e Lp(a)34 possam adicionar informação prognóstica em relação ao LDL-C em alguns subgrupos de pacientes (recomendação II, evidência A).
TRATAMENTO NÃO MEDICAMENTOSO DAS DISLIPIDEMIAS
Terapia nutricional e mudanças de estilo de vida no controle das dislipidemias
A terapia nutricional deve sempre ser adotada. O alcance das metas de tratamento é variável e depende da adesão à dieta, às correções no estilo de vida − perda de peso, atividade física e cessação do tabagismo − e, principalmente, da influência genética da dislipidemia em questão. A utilização de técnicas adequadas de mudança do comportamento dietético é fundamental.
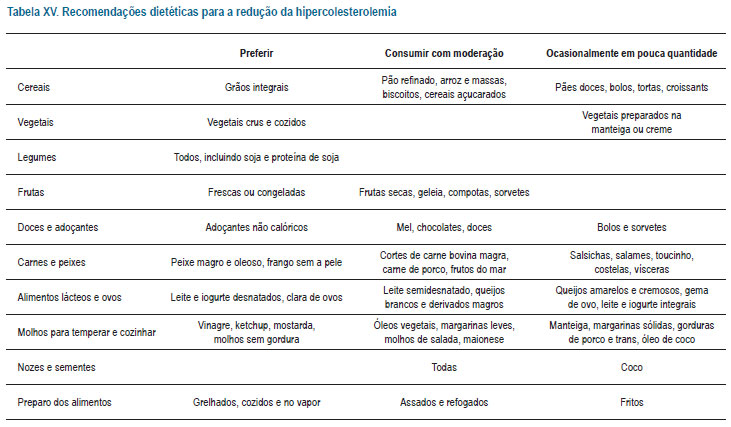
Os níveis séricos de colesterol e TG se elevam em função do consumo alimentar aumentado de colesterol, de carboidratos, de ácidos graxos saturados, de ácidos graxos trans e de excessiva quantidade de calorias. Por isso a seleção adequada destes itens poderá contribuir de maneira eficaz no controle das dislipidemias. É fundamental que as preferências alimentares sejam respeitadas, que a alimentação tenha a composição adequada e o que o paladar seja agradável. O indivíduo deverá ser orientado acerca de como selecionar os alimentos, da quantidade a ser consumida e do modo de preparo, bem como das possíveis substituições dos alimentos. Recomendações dietéticas são apresentadas na Tabela XV. O impacto dessas orientações sobre a lipemia deve ser reconhecido, como mostrado nas Tabelas XVI, XVII e XVIII35.
TRATAMENTO FARMACOLÓGICO DAS DISLIPIDEMIAS
Nas últimas duas décadas, avanços notáveis foram obtidos com o desenvolvimento de hipolipemiantes com potenciais crescentes para redução da hipercolesterolemia, permitindo a obtenção das metas terapêuticas, especialmente do LDL-C. Além das estatinas, resinas e ezetimiba, novas classes têm sido investigadas e serão pormenorizadas a seguir.
Estatinas
Até o presente, a redução do LDL-C por inibidores da hidroximetilglutaril coenzima A (HMG CoA) redutase ou estatinas permanece sendo a terapia mais validada por estudos clínicos para reduzir a incidência de eventos CVs. A depleção intracelular de colesterol estimula a liberação de fatores transcricionais e, consequentemente, a síntese e a expressão na membrana celular de receptores para captação do colesterol circulante, como o LDL-R. Assim, a ação das estatinas pode potencialmente influenciar todo o conjunto das lipoproteínas circulantes que interagem com o LDL-R, como a LDL, a VLDL e remanescentes de quilomícrons.
Além disso, ao inibirem a HMG-CoA redutase, as estatinas reduzem a formação de mevalonato e de radicais isoprenil, atenuando a ativação de proteínas fundamentais à resposta inflamatória e à biodisponibilidade de óxido nítrico36. Numa metanálise com 170 mil pacientes e 26 estudos clínicos, para cada 40 mg/dl de redução do LDL-C com estatinas ocorreu redução da mortalidade por todas as causas em 10%, refletindo em grande parte a redução no número de mortes por DAC (−20%)29. Com base nestas evidências, o uso de estatina está indicado para terapias de prevenção primária e secundária como primeira opção (recomendação I, evidência A).
A redução do LDL-C varia muito entre as estatinas, sendo essa diferença fundamentalmente relacionada com a dose inicial, conforme mostra a Figura 2. A cada vez que dobramos a dose de qualquer uma destas estatinas, a redução média adicional do LDL-C é de 6% a 7%.
As estatinas reduzem os TGs também mediante o aumento da expressão de LDL-R e, consequentemente, pela remoção de lipoproteínas ricas em triglicérides do plasma. Com relação ao HDL-C, as estatinas elevam os níveis plasmáticos por um conjunto de efeitos que inclui estímulo à síntese de apo AI, ABCA1 e ABCG1, inibição da síntese de CETP e do substrato para a troca de triglicérides por colesterol éster via CETP, as lipoproteínas VLDL, IDL e LDL. No entanto, nos estudos de prevenção primária ou secundária com estatinas, a variação do HDL-C ou TG não influenciou a redução de eventos CVs.
Efeitos colaterais são raros no tratamento com estatinas. Entre eles, a miopatia é o mais comum e pode surgir em semanas ou anos após o início do tratamento. A miopatia possui um amplo espectro clínico, variando desde mialgia com ou sem elevação da creatinoquinase (CK) até a rabdomiólise. Nos estudos clínicos, a incidência de miopatia é muito baixa (0,1% a 0,2%) e não está relacionada com a dose. Na prática clínica, há elevação da CK em cerca de 3%39. De forma geral, queixas musculares ocorrem em cerca de 10% dos pacientes que tomam estatinas40. Essa diferença de incidência pode resultar da maior frequência de comorbidades e de terapias múltiplas na prática clínica quando em comparação com os ensaios terapêuticos.
Toxicidade hepática é muito rara, e cerca de 1% dos pacientes apresentam aumentos das transaminases superiores a três vezes o limite superior ao normal, e essa elevação frequentemente diminui, mesmo sem interrupção da terapia41. Portanto a dosagem de transaminases só é aconselhada 6 a 12 semanas após introdução ou aumento de dose das estatinas. A suspensão temporária é aconselhada com elevações superiores a três vezes o valor de referência, e a suspensão definitiva, em casos com infecção hepática ativa ou disfunção hepática grave.
As elevações estáveis das transaminases ou da CK em pacientes sem evidência de doenças agudas e sem queixas, como frequentemente observado na esteatose hepática, não constituem contraindicação para o início de estatina.
Resinas
As resinas, ou sequestradores dos ácidos biliares, são grandes polímeros que ligam os ácidos biliares carregados negativamente e sais biliares no intestino delgado, reduzindo a absorção enteral de colesterol. Como resultado ocorre depleção do colesterol celular hepático, estimulando a síntese de LDL-R e colesterol endógeno. Como consequência desse estímulo à síntese pode ocorrer aumento da produção de VLDL e, consequentemente, dos TGs plasmáticos. Três resinas foram desenvolvidas: a colestiramina, o colestipol e o colesevelam. No entanto, no Brasil, somente a colestiramina está disponível. Essa resina foi testada no estudo Lipid Research Clinics Coronary Prevention Trial (LRC)42, cujo desfecho primário combinado de morte por doença coronariana e infarto do miocárdio foi reduzido em 19%. Em adição às estatinas, não existe estudo clínico que tenha comprovado benefício adicional. Assim, a adição de colestiramina ao tratamento com estatinas é recomendada quando a meta de LDL-C não é obtida apesar do uso de estatinas potentes em doses efetivas (recomendação IIa, evidência C). A redução do LDL-C é dose-dependente e pode variar de 5% a 30% nas doses de 4-24 g/dia. Os principais efeitos colaterais das resinas são constipação (até 25%) e aumento dos TGs em indivíduos com hipertrigliceridemia acentuada (> 400 mg/dl).
Ezetimiba
A ezetimiba inibe a absorção de colesterol na borda em escova do intestino delgado, atuando seletivamente nos receptores Niemann-Pick C1-like protein 1 e inibindo o transporte de colesterol. A inibição da absorção de colesterol, em grande parte do colesterol biliar, leva à diminuição dos níveis de colesterol hepático e ao estímulo à síntese de LDL-R, com consequente redução do nível plasmático de LDL-C de 10% a 25%. Em comparação com placebo, a ezetimiba associada a estatina reduziu eventos CV em pacientes com estenose aórtica degenerativa e doença renal crônica43,44. Em comparação com monoterapia com estatina, um estudo está em andamento testando o benefício adicional da associação estatina e ezetimiba. Com base nesses estudos, a adição da ezetimiba tem sido recomendada quando a meta de LDL-C não é atingida com o tratamento com estatinas (recomendação IIa, evidência C).
Em pequenos estudos, o tratamento com ezetimiba reduziu esteatose hepática não alcoólica45. No entanto o benefício clínico deste efeito ainda requer investigação em ensaios dimensionados para avaliar desfechos clínicos (recomendação IIb, evidência C). Efeitos colaterais são raros, relacionados com alteração do trânsito intestinal.
Niacina
A niacina atua no tecido adiposo periférico, leucócitos e células de Langerhans por meio de sua ligação com um receptor específico ligado à proteína G, o GPR109A. A ativação da GPR109A inibe as lipases hormonossensitivas nos adipócitos e, por esse meio, diminui a liberação de AGs livres na circulação. Em paralelo, a niacina inibe a atividade da enzima diacilglicerol aciltransferase-2 (DGAT-2) nos microssomos dos hepatócitos e, assim, a síntese hepática de TG. Resulta destas ações uma menor disponibilidade de TG intra-hepático e, por consequência, o aumento no catabolismo de apo B e menor secreção de VLDL e LDL. Indiretamente, ocorrem redução da Lp(a) (−26%) e aumento do HDL-C (até 30%).
O Coronary Drug Project46, realizado na década de 1970, demonstrou que o tratamento com niacina na sua forma cristalina pode reduzir a incidência de eventos CVs. Em formulações mais toleráveis, como as formas estendidas, o tratamento com niacina reduziu a espessura média-íntima mesmo em pacientes em uso de estatinas. Em dois estudos clínicos recentes, no entanto, a adição de niacina ao tratamento eficaz com estatinas com ou sem ezetimiba, para meta de LDL-C < 70 mg/dl, não adicionou benefício algum47,48. Em ambos os estudos a taxa de interrupção do tratamento por efeitos colaterais foi cerca de 25%. Ainda assim, não há evidência de benefício com esse fármaco em indivíduos com LDL-C controlado (recomendação III, evidência A).
Fibratos
As ações dos fibratos no metabolismo lipídico decorrem de sua capacidade de imitar a estrutura e as funções biológicas dos AGs livres, ligando-se a fatores de transcrição específicos, os receptores ativados pelo proliferador de peroxissomos (PPARs) expressos primariamente em fígado, rins, coração e músculo. A ativação dos PPARs pelo fibrato ativam uma série de genes relacionados com hidrólise dos TGs (lipase lipoproteica e apolipoproteína CIII), degradação e síntese de AG e HDL. Em geral, as ações no perfil lipídico decorrem deste conjunto de mecanismos, mas variam em sua intensidade entre os fibratos, conforme mostra a Tabela XIX.
Os estudos clínicos disponíveis demonstraram resultados inconsistentes com relação ao benefício da monoterapia com fibrato na redução dos eventos CVs. A genfibrozila foi testada, em monoterapia, em prevenção primária no Helsinki Heart Study (HHS)49 e secundária no Veterans Affairs High-Density Lipoprotein Intervention Trial (VA-HIT)50, e em ambos promoveu redução dos eventos CVs. Igualmente, em monoterapia, o bezafibrato foi testado em prevenção secundária no estudo Bezafibrate Infarction Prevention (BIP)51 e em diabéticos tipo 2 no Fenofibrate Intervention and Event Lowering in Diabetes (FIELD)52, em ambos sem benefício clínico significativo. Numa metanálise com 18 estudos e 45.058 participantes, a terapia com fibratos reduziu o risco relativo de eventos CVs em 10%, eventos coronarianos em 13%, sem benefício em mortalidade CV (recomendação IIa, evidência B)53. Análises retrospectivas destes estudos indicaram haver benefício maior quando foram selecionados pacientes com TGs plasmáticos elevados e HDL-C baixo. No entanto essa informação requer confirmação em estudos prospectivos.
Em associação à estatina, um único estudo testou a adição de fibrato, o fenofibrato, em diabéticos tipo 2. Trata-se do estudo Action to Control Cardiovascular Risk in Diabetes (ACCORD)54, no qual não se observou benefício CV com adição do fibrato, mas redução de eventos microvasculares como amputação, retinopatia e nefropatia. Nos pacientes diabéticos tipo 2 o uso de fibratos para a prevenção de doenças microvasculares tem evidência de estudos em monoterapia e em associação a estatina (recomendação I, evidência A). À semelhança dos estudos em monoterapia, a análise do subgrupo com dislipidemia mista sugeriu benefício macrovascular. Nos pacientes com hipertrigliceridemia e, particularmente, com HDL-C baixo, que estiveram subrepresentados em todos estes estudos (17% no estudo ACCORD), é possível que haja benefício clínico, mas esta possibilidade requer confirmação.
Efeitos colaterais são bastante raros com fibratos, no entanto existem interações clinicamente relevantes de fibratos com estatinas, particularmente entre genfibrozila e sinvastatina. Em geral, o risco de miopatia aumenta com a associação, mas esse aumento não contraindica o uso clínico, requerendo somente monitorização mais cuidadosa da CK. Deve-se evitar a sinvastatina para a associação e não utilizar genfibrozila em alguma associação com estatinas pelo aumento acentuado do risco de rabdomiólise. Os fibratos podem potencializar os efeitos de dicumarínicos, requerendo monitorização da anticoagulação após introdução deste fármaco. Finalmente, o uso dos fibratos deve ser cuidadoso em pacientes renais crônicos.
Ácidos graxos ômega 3
Ácidos graxos ômega-3 (ω-3) são poli-insaturados derivados do óleo de peixes e de certas plantas e nozes. O óleo de peixe contém tanto o ácido docosa-hexaenoico (DHA) quanto o ácido eicosapentaenoico (EPA), mas os óleos de origem vegetal contêm predominantemente o ácido alfa-linolênico (ALA). Em altas doses (4 a 10g ao dia) reduzem os TGs e aumentam discretamente o HDL-C, podendo, entretanto, aumentar o LDL-C. Em um estudo inicial, a suplementação com ω-3 foi relacionada com benefício clínico, mas recentes metanálises não confirmam o benefício dessa terapia na redução de eventos CVs, coronarianos, cerebrovasculares, arritmias ou mortalidade global55,56. Assim, sua indicação na terapia de prevenção CV não está recomendada (recomendação III, evidência A).
NOVOS FÁRMACOS
Inibidores da proteína de transferência de éster de colesterol (CETP)
A CETP é responsável pela transferência de ésteres de colesterol da HDL para lipoproteínas que contêm apo B, em troca equimolar por triglicérides. Como é previsível, a inibição da CETP aumenta a concentração de colesterol na HDL e a diminui nas lipoproteínas que contêm apo B, incluindo VLDL e LDL. No primeiro estudo clínico com inibidor de CETP, o torcetrapib, não se observou redução dos ateromas e houve excesso de mortes e eventos cardiovasculares aparentemente relacionados com a ativação adrenal e a elevação da PA57. Mais recentemente, outro inibidor de menor potência, o dalcetrapib, teve seu estudo interrompido por falta de benefício clínico. Não houve evidência de danos com esse fármaco. Atualmente dois outros inibidores com maior potência de ação estão sendo testados, o anacetrapib e o evacetrapib. Os resultados destes estudos devem esclarecer se há benefício cardiovascular com a inibição da CETP.
Inibidor da Microsomal Transfer Protein (MTP)
A proteína de transferência microssomal de triglicerídeos (MTP) é responsável pela transferência de triglicerídeos para a apolipoproteína B nos hepatócitos durante a síntese de VLDL. Assim, a inibição farmacológica da MTP é uma estratégia potencial para redução dos níveis de colesterol e triglicérides plasmáticos. O lomitapide é um inibidor da MTP que, em estudo preliminar em pacientes homozigotos para HF, mostrou ser capaz de reduzir o LDL-C em até 50,9% após quatro semanas de tratamento3. Em estudos prévios, o lomitapide se associou ao acúmulo de triglicérides hepáticos e, consequentemente, esteatose hepática, por isso sua indicação tem sido proposta para dislipidemias graves. Não existe, até o presente, estudo com tamanha amostra e desfechos clínicos que determinem a segurança e a eficácia na redução de eventos CVs.
Inibidores do Proprotein convertase subtilisin kexin type 9 (PCSK9)
A PCSK9 regula as concentrações de colesterol plasmático por inibir a captação de LDL pelo seu receptor hepático. Indivíduos que apresentam mutações relacionadas com a redução de função da PCSK9 apresentam concentrações mais baixas de LDL-C e menor risco de doença CV. Oligonucleotídeos antissenso são pequenas sequências de nucleotídeos que se ligam ao RNA mensageiro e inibem a síntese proteica. Oligonucleotídeos dirigidos para o gene da PCSK9 e, além destes, anticorpos monoclonais para a proteína PCSK9 foram desenvolvidos. Esses inibidores diminuem o LDL-C em 20% a 50%58. Anticorpos e oligonucleotídeos antissenso para a PCSK9 estão sendo testados em estudos em fases II e III, não havendo, contudo, evidência disponível de benefício clínico até o momento.
Inibidores da síntese de apolipoproteína B
Oligonucleotídeos antissenso para o gene da apolipoproteína B100 reduzem as concentrações plasmáticas de VLDL, LDL e Lp(a). O mipomersen é um oligonucleotídeo de segunda geração administrado por injeção subcutânea semanal na dose de 200 mg. Existem estudos fase 3 com seguimento de até 104 semanas de duração em portadores de HF hetero e homozigótica, além de portadores de hipercolesterolemia poligênica refratários ao tratamento convencional. Na dose de 200 mg/semana o mipomersen diminui, em média, o LDL-C em 25% nas populações estudadas, com respostas variáveis de paciente para paciente (2% a − 80%)2. Na maioria dos estudos os pacientes faziam uso de doses máximas toleradas de estatinas e/ou ezetimiba. As reduções de apo B100 e Lp(a) foram também de 25% a 30%. Os principais efeitos colaterais do mipomersen são reações no local de injeção, sintomas semelhantes aos da gripe e acúmulo de gordura hepática. Até o momento não existe evidência de benefício CV e seu uso tem sido proposto para formas graves de hipercolesterolemia.
DISLIPIDEMIAS EM GRUPOS ESPECIAIS
DISLIPIDEMIAS GRAVES
Valores de LDL-C > 190 mg/dl e TG > 800 mg/dl, isoladamente ou associados, caracterizam uma dislipidemia grave (recomendação I, evidência C). Afastadas as causas secundárias, como hipotireoidismo, diabetes melito descompensado, nefropatia crônica e medicações, deve-se considerar etiologia genética e de caráter familiar. Nessa condição, recomenda-se rastreamento dos familiares próximos, crianças e adultos.
Hipercolesterolemia isolada
Hipercolesterolemia familiar deve ser cogitada sempre que LDL-C >190 mg/dl (recomendação I, evidência C). Sua transmissão genética é de penetração dominante. Pacientes com a forma homozigótica apresentam níveis de colesterol extremamente elevados, mas a forma heterozigótica também cursa com elevações significativas. Os critérios diagnósticos, a conduta e as possibilidades terapêuticas para esta grave dislipidemia estão disponíveis na I Diretriz Brasileira de Hipercolesterolemia Familiar59.
De maneira sucinta, nesses casos são utilizadas, com todo o rigor de seguimento, as medidas usuais de restrição alimentar e posologias elevadas de estatinas, tendo em vista a refratariedade na resposta terapêutica e a cautela necessária quanto aos efeitos adversos desses fármacos, independente da faixa etária (recomendação I, evidência C). A associação com ezetimiba, com a finalidade de se atingirem as metas preconizadas de prevenção, poderá ser empregada60. Medidas de exceção utilizadas no passado, como aférese e by-pass ileal, perderam espaço atualmente após o surgimento das modernas estatinas empregadas em doses mais elevadas e efetivas (recomendação I, evidência C). Entretanto a aférese está indicada aos casos sem resposta ao tratamento farmacológico otimizado em centros habilitados para o procedimento. Somente após insucesso de todos os procedimentos o transplante hepático poderá ser cogitado em centros capacitados para os portadores de HF homozigótica. A introdução no mercado dos novos medicamentos citados poderá ser de extrema utilidade nesses pacientes.
Hipertrigliceridemia isolada
Níveis muito elevados de TG, principalmente > 1.000 mg/dl, representam risco importante de pancreatite aguda e justificam prontas medidas de intervenção de restrição alimentar e farmacológica após investigadas as possíveis doenças metabólicas não compensadas e/ou fármacos em uso. Afastadas as causas secundárias, é fundamental determinar a origem ou classe de TG, se exógena (presença de quilomícron) ou endógena (presença de VLDL), pois isto irá determinar o tipo de dieta, isto é, restrição de gorduras e/ou de carboidratos, caso se evidencie aumento das duas frações.
Os fibratos e a niacina são eficazes no tratamento da hipertrigliceridemia endógena, respeitadas as contraindicações, bem como a atividade física e a perda de peso (recomendação I, evidência C). Muito raramente, níveis elevadíssimos de TG justificam o emprego de aférese em centros especializados a fim de evitar pancreatite recidivante e de alto risco (recomendação I, evidência C).
Associação de hipercolesterolemia e hipertrigliceridemia
Para esta condição de dislipidemia mista, com taxas elevadas, está indicada, além de restrição alimentar, associação de fármacos, a depender da experiência do médico ou grupo responsável (recomendação I, evidência C).
Resistência ao tratamento
Esta situação justifica o encaminhamento dos pacientes de alto risco a grupos ou centros especializados.
IDOSOS
Nos idosos raramente são encontradas grandes elevações, características de caráter genético, entretanto se observam discretas ou moderadas elevações de CT, TG e LDL-C. São mais frequentes as dislipidemias secundárias a hipotireoidismo (principalmente nas mulheres), diabetes melito, intolerância à glicose, síndrome nefrótica, obesidade, alcoolismo ou uso de medicamentos, como diuréticos tiazídicos e bloqueadores beta-adrenérgicos não seletivos.
Em relação ao tratamento, deve-se considerar que o bom estado geral e mental do paciente idoso, as suas condições socioeconômicas, o apoio familiar, as comorbidades presentes e o uso de outros fármacos irão influenciar na adesão e na manutenção da terapêutica. Orientação não farmacológica deve obedecer aos mesmos princípios da indicada para adultos jovens, observando-se mais cuidadosamente as necessidades de aportes calórico, proteico e vitamínico e as condições físicas para a prática de exercícios (recomendação I, evidência B). Devem-se reiterar o abandono do hábito de fumar e a ingestão excessiva de bebidas alcoólicas. Após 90 dias, não havendo resposta, fármacos devem ser indicados, tomando-se como precaução de: (1) iniciar sempre com doses mais baixas e aumentar, se necessário, progressivamente; (2) analisar a relação custo-benefício; e (3) verificar a existência de condições socioeconômicas para a manutenção do tratamento em longo prazo e a realização de exames clínicos e laboratoriais periódicos.
Para a hipercolesterolemia, as estatinas são a primeira escolha61. A tolerância é boa, não há maior incidência de efeitos indesejáveis, embora dores musculares, câimbras e fraqueza, por vezes confundidas com doença osteomuscular, possam ocorrer mesmo com doses baixas. Evidências da análise de subgrupos de estudos de prevenção primária e secundária e o Prospective Study of Pravastatin in the Elderly at Risk (PROSPER)62, especialmente delineado para idosos com ou sem manifestação prévia de aterosclerose, demonstraram os benefícios do tratamento para essa faixa etária: redução de eventos coronarianos (recomendação IIa, evidência B), AVE (recomendação IIa, evidência B) e preservação de funções cognitivas (recomendação IIb, evidência B).
Eventualmente as resinas são utilizadas, mas os efeitos adversos são mais frequentes. Na hipertrigliceridemia, empregam-se os fibratos (se não houver calculose biliar e insuficiência renal). Fibratos e estatinas podem ser associados se houver dislipidemia mista. O emprego do ácido nicotínico é restrito devido à indução de hiperglicemia e hiperuricemia.
Nas dislipidemias secundárias, o cuidado fundamental é o tratamento da doença desencadeante e a substituição ou retirada de medicamentos indutores. Devemos lembrar que os idosos, em geral, utilizam outros fármacos metabolizados no CYP 450 com possibilidade de interação com os hipolipemiantes, alterando sua concentração sérica.
CRIANÇAS E ADOLESCENTES
Recomenda-se a determinação do perfil lipídico quando: (1) avós, pais, irmãos e primos de primeiro grau apresentam dislipidemia, principalmente grave ou manifestação de aterosclerose prematura; (2) há clínica de dislipidemia; (3) tenham outros fatores de risco; (4) há acometimento por outras doenças, como hipotireoidismo, síndrome nefrótica, imunodeficiência etc.; (5) há utilização de contraceptivos, imunossupressores, corticoides, antirretrovirais e outras drogas que possam induzir a elevação do colesterol59,63.
Os valores referenciais preconizados para idades entre 2 e 19 anos são apresentados na Tabela XX (recomendação IIa, evidência B).
As hiperlipidemias primárias mais comumente encontradas nessa faixa etária são: HF homo e heterozigótica, hipertrigliceridemia endógena, hiperquilomicronemia e hiperlipidemia combinada. Entre as causas secundárias, o diabetes melito, o hipotireoidismo e a síndrome nefrótica, além do emprego de medicamentos como a isotretinoína.
Recomenda-se iniciar a terapêutica não farmacológica (dieta, estímulo à atividade física e controle dos outros fatores de risco) aos 2 anos, e a farmacológica, quando necessário, após os 10 anos. São aconselháveis: (1) avaliação dos hábitos de vida dos familiares; (2) priorizar as necessidades energéticas e vitamínicas para a idade; (3) acompanhamento por pediatra e nutricionista (recomendação IIa, evidência C).
Para os estados hipercolesterolêmicos, intervenções dietéticas e de estilo de vida são preconizadas. Os hipercolesterolêmicos heterozigóticos graves e os homozigóticos pouco respondem à dieta (recomendação IIa, evidência B) e, nestes, a terapêutica farmacológica pode ser necessária antes dos 10 anos.
Para os raros casos de hiperquilomicronemia indica-se a restrição acentuada de gorduras, até mesmo antes dos 2 anos de idade, em decorrência do risco de pancreatite. Para a hipertrigliceridemia endógena recomenda-se a diminuição do consumo de carboidratos (recomendação IIa, evidência B).
O uso de medicamentos para a hipercolesterolemia é indicado quando os valores de LDL-C estiverem: (1) > 190 mg/l; (2) > 160 mg/dl, se houver história familiar ou aterosclerose prematura, ou dois ou mais fatores de risco; e (3) acima de 130 mg/dl nos raros casos de comprometimento aterosclerótico (recomendação IIa, evidência B). Os fármacos isolados ou associados deverão ser utilizados de forma contínua. Em estudos em que a administração variou de sete meses a cinco anos, não foram evidenciadas alterações no crescimento pôndero-estatural e na maturação sexual64,65.
As resinas constituem a primeira escolha (recomendação I, evidência B), apesar do sabor desagradável e dos efeitos indesejáveis, não devendo ser administradas na forma homozigótica. As estatinas estão sendo empregadas mais frequentemente nos casos mais graves e, em centros de referência, até mesmo antes dos 10 anos. Recomenda-se iniciar com a menor dose indicada para cada tipo de estatina, aumentar progressivamente e realizar exames clínicos e laboratoriais para o controle de eventuais efeitos adversos. Recentes publicações evidenciaram que as estatinas, além da redução de CT e LCL-C, nessa faixa etária, promoveram melhora da função endotelial, diminuição da espessura íntima-média da carótida e regressão de xantomas (recomendação IIa, evidência B).
Para a hipertrigliceridemia endógena, quando a resposta às intervenções não farmacológicas não for satisfatória, fibratos e AG ômega 3 podem ser administrados, porém a experiência é pequena (recomendação IIb, evidência C).
Em centros de referência, para os casos de dislipidemias graves, podem ser indicadas a plasmaférese ou a LDL-aférese (recomendação IIb, evidência C).
Nos casos de dislipidemias secundárias, a causa de base, responsável pelas alterações lipídicas, deve ser tratada e os medicamentos potencialmente indutores de alterações, retirados ou substituídos.
DISLIPIDEMIAS SECUNDÁRIAS E NA PRESENÇA DE OUTRAS COMORBIDADES
Hipotireoidismo
A dislipidemia presente nos indivíduos com hipotireoidismo é caracterizada pelo aumento das concentrações plasmáticas do LDL-C, consequente ao decréscimo do número de receptores hepáticos para a remoção destas partículas. Já a hipertrigliceridemia aparece em decorrência do aumento da produção hepática das partículas de VLDL.
As alterações nos lípides plasmáticos ocorrem tanto no hipotireoidismo clínico como na forma subclínica. O tratamento com estatinas não está contraindicado para esses indivíduos, no entanto, a estatina só deverá ser iniciada após a regularização dos níveis hormonais, em função do risco aumentado de miosite nesses pacientes66.
A simples reposição hormonal pode corrigir a dislipidemia induzida pelo hipotireoidismo. Mesmo assim, alguns indivíduos permanecem dislipidêmicos, demonstrando a coexistência da dislipidemia primária. No caso, o perfil lipídico poderá ser avaliado para se estabelecer a necessidade do tratamento adicional.
Hepatopatias
A cirrose biliar, a colangite esclerosante e outras hepatopatias que cursam com colestase podem ser acompanhadas de hipercolesterolemia significativa, mas a colesterolemia não se correlaciona com os níveis plasmáticos de bilirrubina. Com relação às doenças hepáticas não colestáticas crônicas e à cirrose hepática, não há contraindicação à terapia com estatinas. Entretanto, diante de surgimento de icterícia, elevação de bilirrubina direta ou aumento do tempo de protrombina, a estatina deve ser suspensa (recomendação IIb, evidência C). A estatina também deverá ser suspensa no surgimento de nova doença hepática, quando não for possível excluí-la como agente causal (recomendação IIb, evidência C).
Doenças autoimunes
As doenças reumáticas autoimunes, incluindo lúpus eritematoso sistêmico (LES), artrite reumatoide, síndrome antifosfolípide, esclerose sistêmica progressiva, síndrome de Sjögren, vasculite sistêmica primária e psoríase, estão associadas a maiores índices de morbidade e mortalidade CVs. A associação se deve ao aumento da prevalência de fatores de risco convencionais para aterosclerose, ao uso de fármacos com potencial efeito aterogênico, como corticoides, e à participação da anormalidade inflamatória e autoimune no processo aterogênico e na trombogênese67,68. O sistema imune está envolvido na patogênese da aterosclerose: componentes inflamatórios da resposta imune, assim como elementos autoimunes (autoanticorpos, autoantígenos e linfócitos autorreativos), contribuem para a vasculite inflamatória e para a disfunção endotelial69.
Embora pacientes com doenças autoimunes possam apresentar risco CV mais elevado, não há indicação de terapia com estatinas em prevenção primária com base exclusivamente na presença da doença autoimune (recomendação III, evidência C). Caso seja necessário o uso de fármacos hipolipemiantes, sua utilização deve ser fundamentada pelas recomendações para as populações não portadoras de doenças autoimunes.
Pós-transplantados
As anormalidades lipídicas são frequentes nos pacientes pós-transplante cardíaco e estão associadas a maior incidência de doença vascular do enxerto. As causas mais comuns da dislipidemia deste grupo se relacionam com diabetes melito, síndrome metabólica, obesidade e disfunção renal.
As medicações imunossupressoras apresentam importantes alterações do metabolismo lipídico, como elevação do CT, VLDL-C, TG e, principalmente, do LDL-C, além de ganho de peso e exacerbação da resistência à insulina. O tratamento com estatinas é o de escolha para os indivíduos pós-transplante cardíaco e dislipidemia, devendo-se iniciar com baixas doses (recomendação IIa, evidência B)70,71. Nestes casos, deve-se monitorar o risco de toxicidade muscular devido à interação das estatinas com a ciclosporina, principalmente as que utilizam a via CYP3A472,73. Para os pacientes intolerantes às estatinas, a ezetimiba pode ser uma alternativa com o objetivo de redução do LDL-C (recomendação IIb, evidência C)74.
SITUAÇÕES ESPECIAIS NAS MULHERES
Os benefícios da redução lipídica em mulheres são os mesmos observados em homens29, portanto, para definição de metas lipídicas, não há distinção entre os sexos.
Idade fértil e gestação
A terapia com estatinas deve ser evitada em mulheres em idade fértil e sem contracepção adequada ou que desejem engravidar, gestantes e lactantes (recomendação IIa, evidência C). A contraindicação deve-se a relatos de teratogenicidade, embora as informações disponíveis na literatura sejam inconclusivas75. Da mesma forma, outros fármacos hipolipemiantes devem ser evitados na gestação. Os fibratos poderão ser considerados nos casos de hipertrigliceridemia muito grave (TG > 1.000 mg/dl), sob a análise de risco/benefício para as gestantes (alta mortalidade para mãe e feto por pancreatite aguda durante a gravidez). Entretanto o controle dietético deve ser o tratamento de eleição em gestantes (recomendação IIa, evidência C), e, em casos extremos, a aférese poderá ser recomendada.
Menopausa/climatério
A terapia de reposição hormonal (TRH) após a menopausa pode reduzir o LDL-C em até 20%-25% e aumentar o HDL-C em até 20%. Entretanto esta terapêutica nunca está recomendada com a finalidade exclusiva de reduzir o risco CV em mulheres no período de transição menopáusica ou da pós-menopausa, seja em prevenção primária ou secundária (recomendação III, evidência A). Nas mulheres em prevenção primária com indicações ginecológicas para a TRH (controle de sintomas vasomotores e osteoporose), pode haver benefício CV quando iniciada na transição menopáusica ou nos primeiros anos de pós-menopausa, na chamada "janela de oportunidade" (recomendação IIb, evidência B)76. Ainda na prevenção primária, pode haver aumento do risco quando a TRH é iniciada tardiamente. A TRH deve ser evitada nas mulheres de alto risco ou de prevenção secundária (recomendação III, evidência A). Naquelas em uso regular de TRH que apresentarem evento CV, a TRH deverá ser interrompida imediatamente (recomendação III, evidência A).
Doença renal crônica
A diminuição da função renal, avaliada pela taxa de filtração glomerular (TFG) mensurada ou calculada, está associada a maior mortalidade CV. Por esta razão, a presença de doença renal crônica (DRC), em especial nos estágios mais avançados, é considerada risco-equivalente à DAC, e a redução de LDL-C deverá ser o objetivo principal no tratamento destes pacientes (recomendação I, evidência A).
Nas fases iniciais da doença renal (estágios 1 e 2), as modificações lipídicas preponderantes são hipertrigliceridemia e HDL-C baixo. Com a evolução da DRC, torna-se mais comum a elevação do LDL-C. Além disso, há um estado pró-aterogênico por mudança no fenótipo da molécula de LDL (maior concentração de moléculas pequenas e densas) e pelo próprio meio urêmico. Portanto todo indivíduo portador de DRC deve ser avaliado quanto à presença de dislipidemias (recomendação IIa, evidência B).
A redução de LDL-C está associada a redução do risco CV em pacientes com DRC77. Entretanto, estudos realizados apenas com pacientes já em fase dialítica (hemodiálise) falharam em mostrar este benefício78,79. Portanto o tratamento com estatinas não deve ser iniciado em pacientes que já se encontrem em tratamento hemodialítico (recomendação III, evidência A). Nos demais pacientes, em especial naqueles com DRC avançada, a meta de LDL-C < 70 mg/dl deve ser atingida com estatina isolada ou associada à ezetimiba (recomendação IIa, evidência B)80.
Síndrome coronariana aguda
Amostra de sangue para avaliação do perfil lipídico deve ser obtida nas primeiras 24 horas da admissão de todos os pacientes com síndrome coronariana aguda (SCA). Após este período, comumente ocorre aumento de TG e diminuição do LDL-C e do HDL-C, modificações que podem permanecer por cerca de um a três meses. Recomenda-se a instituição precoce do tratamento com altas doses de estatina entre o primeiro e o quarto dia da SCA (recomendação I, evidência A), preferencialmente atorvastatina na dose 80 mg81,82. Pacientes indicados para intervenção percutânea e angioplastia podem experimentar benefício adicional quando a dose de estatina for administrada até 12 horas antes do procedimento (recomendação IIa, evidência B)83. O perfil lipídico deve ser reavaliado após quatro a seis semanas. A dose de estatina apropriada para manter o LDL-C na meta terapêutica (< 70 mg/dl) deverá ser mantida (recomendação I, evidência A). Não há, até o momento da publicação deste documento, embasamento para o uso de qualquer outro fármaco hipolipemiante na fase aguda das síndromes coronárias.
Nota: o conjunto de recomendações emitidas nesta Diretriz, de forma geral, reflete as evidências científicas de efetividade das intervenções. Sua finalidade é orientar os profissionais da saúde no atendimento de portadores de dislipidemias objetivando prevenir a aterosclerose ou reduzir as suas complicações. O documento não aborda, de forma sistemática, análises de custo-efetividade, não devendo ser encarado como guia global absoluto para serviços preventivos de saúde pública.
Errata
A "V Diretriz Brasileira de Dislipidemias e Prevenção da Aterosclerose", publicada como suplemento número um da edição de setembro de 2013 dos Arquivos Brasileiros de Cardiologia [Arq Bras Cardiol. 2013; 101(4Supl.1): 1-22], sofreu as seguintes correções nas tabelas IV e VI: substituir os valores de pressão "120-139" por "120-129".
- 1. Altmann SW, Davis HR Jr, Zhu LJ, Yao X, Hoos LM, Tetzloff G, et al. Niemann-Pick C1 Like 1 protein is critical for intestinal cholesterol absorption. Science.2004;303(5661):1201-4.
- 2. Raal FJ, Santos RD, Blom DJ, Marais AD, Charng MJ, Cromwell WC, et al.Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial. Lancet.2010;375(9719):998-1006.
- 3. Cuchel M, Bloedon LT, Szapary PO, Kolansky DM, Wolfe ML, Sarkis A, et al. Inhibition of microsomal triglyceride transfer protein in familial hypercholesterolemia. N Engl J Med.2007;356(2):148-56.
- 4. Tall AR. CETP inhibitors to increase HDL cholesterol levels. N Engl J Med.2007;356(13):1364-6.
- 5. Horton JD, CohenJC, HobbsHH. PCSK9: a convertase that coordinates LDL catabolism. J Lipid Res.2009;50 Suppl:S172-7.
- 6. Steinberg D, Witztum JL. Inhibition of PCSK9: a powerful weapon for achieving ideal LDL cholesterol levels. Proc Natl Acad Sci U S A. 2009;106(24):9546-7.
- 7. Ross R. Atherosclerosis--an inflammatory disease. N Engl J Med. 1999;340(2):115-26.
- 8. Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med. 2005;352(16):1685-95.
- 9. Libby P, Theroux P. Pathophysiology of coronary artery disease. Circulation. 2005;111(25):3481-8.
-
10Recomendations for Improving Cholesterol Measurement. A report from the Laboratory Standardization Panel of the National Cholesterol Education Program. National Heart, Lung and Blood Institute; NIH Publication n� 93-2964. Bethesda, MD; 1993.
- 11. Sposito AC, Caramelli B, Fonseca FA, Bertolami MC, Afiune Neto A, Souza AD, et al.; Sociedade Brasileira de Cardiologia. IV Diretriz brasileira sobre dislipidemias e prevenção da aterosclerose. Arq Bras Cardiol. 2007;88(supl 1):1-18.
- 12. Wilson PW, D'Agostino RB, Levy D, Belanger AM, Silbershatz H, Kannel WB. Prediction of coronary heart disease using risk factor categories. Circulation. 1998;97(18):1837-47.
- 13. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive summary of the third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA. 2001;285(19):2486-97.
- 14. Ridker PM, Buring JE, Rifai N, Cook NR. Development and validation of improved algorithms for the assessment of global cardiovascular risk in women: the Reynolds Risk Score. JAMA. 2007;297(6):611-9.
- 15. 15. Ridker PM, Paynter NP, Rifai N, Gaziano JM, Cook NR. C-reactive protein and parental history improve global cardiovascular risk prediction: the Reynolds Risk Score for men. Circulation. 2008;118(22):2243-51.
- 16. D'Agostino RB, Vasan RS, Pencina MJ, Wolf PA, Cobain M, Massaro JM, et al. General cardiovascular risk profile for use in primary care: the Framingham Heart Study. Circulation. 2008;117(6):743-53.
- 17. Lloyd-Jones DM, Leip EP, Larson MG, D'Agostino RB, Beiser A, Wilson PW, et al. Prediction of lifetime risk for cardiovascular disease by risk factor burden at 50 years of age. Circulation. 2006;113(6):791-8.
- 18. Berry JD, Dyer A, Cai X, Garside DB, Ning H, Thomas A, et al. Lifetime risks of cardiovascular disease. N Engl J Med. 2012;366(4):321-9.
- 19. Fox CS, Pencina MJ, Wilson PW, Paynter NP, Vasan RS, D'Agostino RB Sr. Lifetime risk of cardiovascular diseaseamong individuals with and without diabetes stratified by obesity status in the Framingham Heart Study. Diabetes Care. 2008;31(8):1582-4.
- 20. Catapano AL, Reiner Z, De Backer G, Graham I, Taskinen MR, Wiklund O, et al; European Society of Cardiology (ESC); European Atherosclerosis Society (EAS). ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis. 2011;217(1):3-46.
- 21. Den Ruijter HM, Peters SA, Anderson TJ, Britton AR, Dekker JM, Eijkemans MJ, et al. Common carotid intima-media thicknessmeasurements in cardiovascular risk prediction: a meta-analysis. JAMA. 2012;308(8):796-803.
- 22. Yeboah J, McClelland LR, Polonski TS, Burke GL, Sibley CT, O'Leary D, et al. Comparison of novel risk markers for improvement in cardiovascular risk assessment in intermediate-risk individuals. JAMA. 2012;308(8):788-95.
- 23. Mosca L, Benjamin EJ, Berra K, Bezanson JL, Dolor RJ, Lloyd-Jones DM, et al. Effectiveness-based guidelines for the prevention of cardiovascular disease in women - 2011 update: a guideline from the American Heart Association. Circulation. 2011;123(11):1243-62. Erratum in: Circulation. 2011;123(22):e624. Circulation. 2011;124(16):e427.
- 24. Alberti KG, Zimmet P, Shaw J; IDF Epidemiology Task Force Consensus Group. The metabolic syndrome -- a new worldwide definition. Lancet. 2005;366(9491):1059-62.
- 25. IDF Clinical Guidelines Task Force. Global Guideline for Type 2 Diabetes: recommendations for standard, comprehensive, and minimal care. Diabet Med. 2006;23(6):579-93.
- 26. Ridker PM, Danielson E, Fonseca FA, Genest J, Gotto AM Jr, Kastelein JJ, et al; JUPITER Trial Study Group. Reduction in C-reactive protein and LDL cholesterol and cardiovascular event rates after initiation of rosuvastatin: a prospective study of the JUPITER trial. Lancet. 2009;373(9670):1175-82.
- 27. Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, et al; INTERHEART Study Investigators. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet. 2004;364(9438):937-52.
- 28. Lewington S, Whitlock G, Clarke R, Sherliker P, Emberson J, Halsey J, et al; Prospective Studies Collaboration. Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths. Lancet. 2007;370(9602):1829-39.
- 29. Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, et al; Cholesterol Treatment Trialists' (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-81.
- 30. Ference BA, Yoo W, Alesh I, Mahajan N, Mirowska KK, Mewada A, et al. Effect of long-term exposure to lower low-density lipoprotein cholesterol beginning early in life on the risk of coronary heart disease: a Mendelian randomization analysis. J Am Coll Cardiol. 2012;60(25):2631-9.
- 31. Fonseca FA, França CN, Póvoa RM, Izar MC. [Statins and stroke: potential mechanisms for neurovascular protection]. Rev Neurol. 2010;51(9):551-60.
- 32. Robinson JG, Wang S, Jacobson TA. Meta-analysis of comparison of effectiveness of lowering apolipoprotein B versus low-density lipoprotein cholesterol and nonhigh-density lipoprotein cholesterol for cardiovascular risk reduction in randomized trials. Am J Cardiol. 2012;110(10):1468-76.
- 33. Chien KL, Hsu HC, Su TC, Chen MF, Lee YT, Hu FB. Apolipoprotein B and non-high density lipoprotein cholesterol and the risk of coronary heart disease in Chinese. J Lipid Res. 2007;48(11):2499-505.
- 34. Helgadottir A, Gretarsdottir S, Thorleifsson G, Holm H, Patel RS, Gudnason T, et al. Apolipoprotein(a) genetic sequence variants associated with systemic atherosclerosis and coronary atherosclerotic burden but not with venous thromboembolism. J Am Coll Cardiol. 2012;60(8):722-9.
- 35. Reiner Z, Catapano AL, De Backer G, Graham I, Taskinen MR, Wiklund O, et al; European Association for Cardiovascular Prevention & Rehabilitation, ESC Committee for Practice Guidelines (CPG) 2008-2010 and 2010-2012 Committees. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J. 2011;32(14):1769-818.
- 36. Sposito AC, Chapman MJ. Statin therapy in acute coronary syndromes: mechanistic insight into clinical benefit. Arterioscler Thromb Vasc Biol. 2002;22(10):1524-34.
- 37. Mukhtar RY, Reid J, Reckless JP. Pitavastatin. Int J Clin Pract. 2005;59(2):239-52.
- 38. Weng TC, Yang YH, Lin SJ, Tai SH. A systematic review and meta-analysis on the therapeutic equivalence of statins. J Clin Pharm Ther. 2010;35(2):139-51.
- 39. Smith CC, Bernstein LI, Davis RB, Rind DM, Shmerling RH. Screening for statin-related toxicity: the yield of transaminase and creatine kinase measurements in a primary care setting. Arch Intern Med. 2003;163(6):688-92.
- 40. Thompson PD, Clarkson PM, Rosenson RS; National Lipid Association Statin Safety Task Force Muscle Safety Expert Panel. An assessment of statin safety by muscle experts. Am J Cardiol. 2006;97(8A):69C-76C.
- 41. Kashani A, Phillips CO, Foody JM, Wang Y, Mangalmurti S, Ko DT, et al. Risks associated with statin therapy: a systematic overview of randomized clinical trials. Circulation. 2006;114(25):2788-97.
- 42. The Lipid Research Clinics Coronary Primary Prevention Trial results. I. Reduction in incidence of coronary heart disease. JAMA. 1984;251(13):351-64.
- 43. Baigent C, Landray MJ, Reith C, Emberson J, Wheeler DC, Tomson C, et al; SHARP Investigators. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet 2011;377:2181-92.
- 44. Rossebo AB, Pedersen TR, Boman K, Brudi P, Chambers JB, Egstrup K, et al; SEAS Investigators. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis. N Engl J Med. 2008;359(13):1343-56.
- 45. Park H, Shima T, Yamaguchi K, Mitsuyoshi H, Minami M, Yasui K, et al. Efficacy of long-term ezetimibe therapy in patients with nonalcoholic fatty liver disease. J Gastroenterol. 2011;46(1):101-7.
- 46. Clofibrate and niacin in coronary heart disease. JAMA. 1975;231(4):360-81.
- 47. HPS2-THRIVE Collaborative Group. HPS2-THRIVE randomized placebo-controlled trial in 25 673 high-risk patients of ER niacin/laropiprant: trial design, pre-specified muscle and liver outcomes, and reasons for stopping study treatment. Eur Heart J. 2013;34(17):1279-91.
- 48. Boden WE, Probstfield JL, Anderson T, Chaitman BR, Desvignes-Nickens P, Koprowicz K, et al; AIM-HIGH Investigators. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med. 2011;365(24):2255-67. Erratum in N Engl J Med. 2012;367(2):189.
- 49. Frick MH, Elo O, Haapa K, Heinonen OP, Heinsalmi P, Helo P, et al. Helsinki Heart Study: primary-prevention trial with gemfibrozil in middle-aged men with dyslipidemia. Safety of treatment, changes in risk factors, and incidence of coronary heart disease. N Engl J Med. 1987;317(20):1237-45.
- 50. Robins SJ, Collins D, Wittes JT, Papademetriou V, Deedwania PC, Schaefer EJ, et al; VA-HIT Study Group. Veterans Affairs High-Density Lipoprotein Intervention Trial. Relation of gemfibrozil treatment and lipid levels with major coronary events: VA-HIT: a randomized controlled trial. JAMA. 2001;285(12):1585-91.
- 51. Secondary prevention by raising HDL cholesterol and reducing triglycerides in patients with coronary artery disease: the Bezafibrate Infarction Prevention (BIP) study. Circulation. 2000;102(1):21-7.
- 52. Keech A, Simes RJ, Barter P, Best J, Scott R, Taskinen MR, et al; FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet. 2005;366(9500):1849-61. Erratum in Lancet. 2006;368(9545):1415, Lancet. 2006;368(9545):1420
- 53. Jun M, Foote C, Lv J, Neal B, Patel A, Nicholls SJ, et al. Effects of fibrates on cardiovascular outcomes: a systematic review and meta-analysis. Lancet. 2010;375(9729):1875-84.
- 54. Ginsberg HN, Elam MB, Lovato LC, Crouse JR 3rd, Leiter LA, Linz P, et al; ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med. 2010;362(17):1563-74. Erratum in: N Engl J Med. 2010;362(18):1748.
- 55. Chowdhury R, Stevens S, Gorman D, Pan A, Warnakula S, Chowdhury S, et al. Association between fish consumption, long chain omega 3 fatty acids, and risk of cerebrovascular disease: systematic review and meta-analysis. BMJ. 2012;345:e6698.
- 56. Kotwal S, Jun M, Sullivan D, Perkovic V, Neal B. Omega 3 Fatty acids and cardiovascular outcomes: systematic review and meta-analysis. Circ Cardiovasc Qual Outcomes. 2012;5(6):808-18.
- 57. Barter PJ, Caulfield M, Eriksson M, Grundy SM, Kastelein JJ, Komajda M, et al; ILLUMINATE Investigators. Effects of torcetrapib in patients at high risk for coronary events. N Engl J Med. 2007;357(12):2109-22.
- 58. Ni YG, Di Marco S, Condra JH, Peterson LB, Wang W, Wang F, et al. A PCSK9-binding antibody that structurally mimics the EGF(A) domain of LDL-receptor reduces LDL cholesterol in vivo. J Lipid Res. 2011;52(1):78-86.
- 59. Santos RD, Gagliardi AC, Xavier HT, Casella Filho A, Araujo DB, Cesena FY, et al. [In Process Citation]. Arq Bras Cardiol. 2012;99(2 Suppl 2):1-28.
- 60. Gagné C, Gaudet D, Bruckert E; Ezetimibe Study Group. Efficacy and safety of ezetimibe coadministered with atorvastatin or simvastatin in patients with homozygous familial hypercholesterolemia. Circulation. 2002;105(21):2469-75.
- 61. Long SB, Blaha MJ, Blumenthal RS, Michos ED. Clinical utility of rosuvastatin and other statins for cardiovascular risk reduction among the elderly. Clin Interv Aging. 2011;6:27-35.
- 62. Shepherd J, Blauw GJ, Murphy MB, Bollen EL, Buckley BM, Cobbe SM, et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet. 2002;360(9346):1623-30.
- 63. Sociedade Brasileira de Cardiologia. Departamento de Aterosclerose. I Diretriz de prevenção da aterosclerose na infância e na adolescência da Sociedade Brasileira de Cardiologia. Arq Bras Cardiol. 2005;85(supl 6):1-35.
- 64. McCrindle BW, Urbina EM, Dennison BA, Jacobson MS, Steinberger J, Rocchini AP, et al; American Heart Association Atherosclerosis, Hypertension, and Obesity in Youth Committee; American Heart Association Council of Cardiovascular Disease in the Young; American Heart Association Council on Cardiovascular Nursing. Drug therapy of high-risk lipid abnormalities in children and adolescents: a scientific statement from the American Heart Association Atherosclerosis, Hypertension, and Obesity in Youth Committee, Council of Cardiovascular Disease in the Young, with the Council on Cardiovascular Nursing. Circulation. 2007;115(14):1948-67.
- 65. Arambepola C, Farmer AJ, Perera R, Neil HA. Statin treatment for children and adolescents with heterozygous familial hypercholesterolaemia: a systematic review and meta-analysis. Atherosclerosis. 2007;195(2):339-47.
- 66. Ladenson PW, Kristensen JD, Ridgway EC, Olsson AG, Carlsson B, Klein I, et al. Use of the thyroid hormone analogue eprotirome in statin-treated dyslipidemia. N Engl J Med. 2010;362(10):906-16.
- 67. Peters MJ, Symmons DP, McCarey D, Dijkmans BA, Nicola P, Kvien TK, et al. EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann Rheum Dis. 2010;69(2):325-31.
- 68. Gladman DD, Ang M, Su L, Tom BD, Schentag CT, Farewell VT. Cardiovascular morbidity in psoriatic arthritis. Ann Rheum Dis. 2009;68(7):1131-5.
- 69. Thorburn CM, Ward MM. Hospitalizations for coronary artery disease among patients with systemic lupus erythematosus. Arthritis Rheum. 2003;48(9):2519-23.
- 70. Kobashigawa JA, Katznelson S, Laks H, Johnson JA, Yeatman L, Wang XM, et al. Effect of pravastatin on outcomes after cardiac transplantation. N Engl J Med. 1995;333(10):621-7.
- 71. Wenke K, Meiser B, Thiery J, Nagel D, von Scheidt W, Steinbeck G, et al. Simvastatin reduces graft vessel disease and mortality after heart transplantation: a four-year randomized trial. Circulation. 1997;96(5):1398-402.
- 72. Page RL 2nd, Miller GG, Lindenfeld J. Drug therapy in the heart transplant recipient: part IV: drug-drug interactions. Circulation. 2005;111(2):230-9.
- 73. Navaneethan SD, Nigwekar SU, Perkovic V, Johnson DW, Craig JC, Strippoli GF. HMG CoA reductase inhibitors (statins) for dialysis patients. Cochrane Database Syst Rev. 2009 Jul 8;(3):CD004289.
- 74. Shaw SM, Chaggar P, Ritchie J, Shah MK, Baynes AC, O'Neill N, et al. The efficacy and tolerability of ezetimibe in cardiac transplant recipients taking cyclosporin. Transplantation. 2009;87(5):771-5.
- 75. Kazmin A, Garcia-Bournissen F, Koren G. Risks of statin use during pregnancy: a systematic review. J Obstet Gynaecol Can. 2007;29(11):906-8.
- 76. Rossouw JE, Prentice RL, Manson JE, Wu L, Barad D, Barnabei VM, et al. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA. 2007;297(13):1465-77.
- 77. Upadhyay A, Earley A, Lamont JL, Haynes S, Wanner C, Balk EM. Lipid-lowering therapy in persons with chronic kidney disease: a systematic review and meta-analysis. Ann Intern Med. 2012;157(4):251-62.
- 78. Wanner C, Krane V, Marz W, Olschewski M, Mann JF, Ruf G, et al; German Diabetes and Dialysis Study Investigators. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med. 2005;353(3):238-48. Erratum in: N Engl J Med. 2005;353(15):1640.
- 79. Fellstrom BC, Jardine AG, Schmieder RE, Holdaas H, Bannister K, Beutler J, et al; AURORA Study Group. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med. 2009;360(14):1395-407.
- 80. Baigent C, Landray MJ, Reith C, Emberson J, Wheeler DC, Tomson C, et al; SHARP Investigators. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet. 2011;377(9784):2181-92.
- 81. Cannon CP, Braunwald E, McCabe CH, Rader DJ, Rouleau JL, Belder R, et al; Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis in Myocardial Infarction 22 Investigators. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med. 2004;350(15):1495-504.
- 82. Schwartz GG, Olsson AG, Ezekowitz MD, Ganz P, Oliver MF, Waters D, et al. Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering (MIRACL) Study Investigators. Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled trial. JAMA. 2001;285(13):1711-8.
- 83. Patti G, Pasceri V, Colonna G, Miglionico M, Fischetti D, Sardella G, et al. Atorvastatin pretreatment improves outcomes in patients with acute coronary syndromes undergoing early percutaneous coronary intervention: results of the ARMYDA-ACS randomized trial. J Am Coll Cardiol. 2007;49(12):1272-8.
Correspondência:
Datas de Publicação
-
Publicação nesta coleção
07 Nov 2013 -
Data do Fascículo
Out 2013