RESUMO
O acúmulo e a compartimentalização de zinco são distintos entre as espécies florestais. O objetivo do trabalho foi, portanto, avaliar a capacidade de acumulação e de translocação de zinco em mudas de Eucalyptus e Corymbia em solo contaminado com zinco. O experimento foi conduzido no período de outubro de 2011 a março de 2012, em casa de vegetação, em delineamento experimental inteiramente casualizado, com arranjo fatorial (4 x 8), com doze repetições. Foram utilizadas quatro espécies: Eucalyptus. grandis W. Hill ex Maid., Eucalyptus. salignaSmith, Eucalyptus. dunnii Maiden e Corymbia citriodora (Hook.) K.D. Hill & L.A.S. Johnson, e oito doses de zinco (0, 140, 280, 420, 560, 700, 840 e 980 mg kg-1 de solo). As mudas das espécies florestais mostraram comportamento diferenciado em relação às doses de zinco aplicadas no solo com redução na massa seca da parte aérea. O E. dunnii apresenta maior redução na altura de planta, volume radicular, área foliar e massa seca radicular em relação às demais espécies. O C. citriodora apresenta maior acumulação de zinco na parte aérea e índice de translocação e baixo coeficiente de impacto do teor relativo com as doses aplicadas no solo, indicando tolerância em solos contaminados.
Palavras-chave:
eucalipto; solo contaminado; absorção de zinco
ABSTRACT
The zinc accumulation and compartmentalization are distinct among forest species. The objective of this study was to evaluate the ability of zinc accumulation and translocation in seedlings of Eucalyptus and Corymbia in soil contaminated with zinc. The experiment was conducted during October 2011 and March 2012, in a greenhouse, in a completely randomized design, in factorial arrangement (4 x 8), with 12 replicates. Four species were used: Eucalyptus. grandis W. Hill ex Maid., Eucalyptus. saligna Smith, Eucalyptus. dunnii Maiden and Corymbia citriodora (Hook.) K.D. Hill & L.A.S. Johnson, and eight doses (0, 140, 280, 420, 560, 700, 840 and 980 mg of Zn kg-1 of soil). The seedlings of forest species showed different behavior relative to zinc doses applied in the soil, reducing the dry mass of aerial parts. The E. dunnii presents higher reduction in plant height, root volume, leaf area and root dry mass than other species. The C. citriodora has higher zinc accumulation in aerial parts as well as translocation index, and has low coefficient of impact of relative content with doses applied on the soil, indicating tolerance in contaminated soils.
Key words:
eucalyptus; contaminated soil; heavy metal; zinc absorption
Introdução
A contaminação do solo com zinco pode ocorrer pelo descarte de forma inadequada de equipamentos eletrônicos, baterias, aparelhos domésticos, rejeitos de mineração ou pela aplicação em excesso de dejetos de suínos, lodo de esgoto, biossólido, pesticidas e fertilizantes fosfatados (Hooda, 2010Hooda, P. S. Trace elements in soils. 1.ed. United Kingdom: Wiley-Blackwell, 2010. 616p. http://dx.doi.org/10.1002/9781444319477
http://dx.doi.org/10.1002/9781444319477...
; Kabata-Pendias, 2011Kabata-Pendias, A. Trace elements in soils and plants. 4.ed. Boca Raton: CRC Press/Taylor & Francis Group, 2011. 548p.; Basso et al., 2012Basso, C. J.; Ceretta, C. A.; Flores, E. M. M.; Girotto, E. Teores totais de metais pesados no solo após aplicação de dejeto líquido de suínos. Ciência Rural, v.42, p.653-659, 2012. http://dx.doi.org/10.1590/S0103-84782012000400012
http://dx.doi.org/10.1590/S0103-84782012...
). Nos solos, teores totais de até 60 mg kg-1 são considerados como referência de qualidade ambiental e de 450 mg kg-1 para a intervenção em áreas destinadas à atividade agrícola (CONAMA, 2009CONAMA - Conselho Nacional do Meio Ambiente. Resolução Nº 420 de 28 de dezembro de 2009. Dispõe sobre critérios e valores orientadores de qualidade do solo quanto à presença de substâncias químicas e estabelece diretrizes para o gerenciamento ambiental de áreas contaminadas por essas substâncias em decorrência de atividades antrópicas. Diário Oficial da República Federativa do Brasil, Brasília, DF, 31 de dezembro de 2009. <http://www.mma.gov.br/port/conama/res/res09/res42009.pdf>. 21 Jul. 2014.
http://www.mma.gov.br/port/conama/res/re...
).
O zinco, embora seja considerado um nutriente essencial para o desenvolvimento das plantas, é absorvido em pequenas quantidades (Hooda, 2010Hooda, P. S. Trace elements in soils. 1.ed. United Kingdom: Wiley-Blackwell, 2010. 616p. http://dx.doi.org/10.1002/9781444319477
http://dx.doi.org/10.1002/9781444319477...
), geralmente fitotóxico em teores acima de 300 mg kg-1 na massa seca da parte aérea da planta (Broadley et al., 2007Broadley, M. R.; White, P. J.; Hammond, J. P.; Zelko, I.; Lux, A. Zinc in plants. New Phytologist, v.173, p.677-702, 2007. http://dx.doi.org/10.1111/j.1469-8137.2007.01996.x
http://dx.doi.org/10.1111/j.1469-8137.20...
). Entretanto, existe uma estreita relação entre produção de biomassa e zinco acumulado na parte aérea das plantas arbóreas (Santana et al., 1999Santana, R. C.; Júlio, N. F. B.; Neves, C. L. Biomassa e conteúdo de nutrientes de procedências de Eucalyptus grandis e Eucalyptus saligna em alguns sítios florestais do Estado de São Paulo. Scientia Forestalis, v.56, p.155-169, 1999.). Deste modo, espécies florestais para produção de madeira que tolerem altas concentrações do metal e produzam elevada fitomassa, são indicadas para imobilizar metais por longos períodos (García et al., 2004García, G.; Faz, Á.; Cunha, M. Performance of Piptatherum miliaceum (Smilo grass) in edaphic Pb and Zn phytoremediation over a short growth period. International Biodeterioration & Biodegradation, v.54, p.245-250. 2004. http://dx.doi.org/10.1016/j.ibiod.2004.06.004
http://dx.doi.org/10.1016/j.ibiod.2004.0...
).
Nesse sentido, espécies florestais da família da mirtaceae, gênero Eucalyptus e Corymbia, apresentam potencial de serem utilizadas em solos contaminados com metais pesados (Magalhães et al., 2011Magalhães, M. O. L.; Amaral Sobrinho, N. M. B. do; Santos, F. S.; Mazur, N. Potencial de duas espécies de eucalipto na fitoestabilização de solo contaminado com zinco. Revista Ciência Agronômica, v.42, p.805-812, 2011. http://dx.doi.org/10.1590/S1806-66902011000300029
http://dx.doi.org/10.1590/S1806-66902011...
). O E. grandis, E. saligna e o C. citriodora estão entre as 10 espécies florestais mais cultivadas, por consequência das altas produções e ampla utilização da madeira (Harwood, 2011Harwood, C. New Introductions: Doing it right. In: Walker, J. (ed.) Developing a eucalypt resource. Learning from Australia and Elsewhere. Christchurch: Wood Technology Research Centre, University of Canterbury, 2011. p.43-54..), além do E. dunniiapresentar moderada resistência ao frio (Zhuang et al., 2010Zhuang, G.; Hu, T.; Guo, H.; Liu, J.; Chen, Z.; Yang, X. Comparision on cold resistance of Eucalyptus from different provenances. Eucalypt Science & Technology, v.27, p.23-35, 2010.).
Apesar dos estudos que demostram o potencial de acumulação de metais na parte aérea das plantas (Ramos et al., 2009Ramos, S.; Castro, E. M.; Carmo Pinto, S. I.; Faquin, V.; Oliveira, C.; Pereira, G. C. Uso do silício na redução da toxidez de zinco em mudas de eucalipto. Interciencia, v.34, p.189-194, 2009.) e da compartimentação do contaminante no caule, folhas e raízes (Pereira et al., 2013Pereira, A. C. C.; Amaral Sobrinho, N. M. B .do; Sampaio Júnior, J.; Oliveira, J. A.; Santos, F. S. dos; Mazur, N. Comportamento da Cordia africana Lam. cultivada em solo contaminado por metais pesados e tratado com materiais amenizantes. Ciência Florestal, v.23, p.329-336, 2013. http://dx.doi.org/10.5902/1980509810544
http://dx.doi.org/10.5902/1980509810544...
), são poucos os trabalhos que relatam a capacidade de translocação do zinco das raízes para a parte aérea em mudas de diferentes espécies florestais indicando sua tolerância a solos contaminados com o metal (Silveira et al., 2003Silveira, M. L. A.; Alleoni, L. R. F.; Guilherme, L. R. G. Biosolids and heavy metals in soils. Scientia Agricola, v.60, p.793-806, 2003. http://dx.doi.org/10.1590/S0103-90162003000400029
http://dx.doi.org/10.1590/S0103-90162003...
; Graziotti et al., 2003Grazziotti, P. H.; Siqueira, J. O.; Moreira, F. M. S. Espécies arbóreas e ectomicorrizas em relação ao excesso e metais pesados. In: Curi, R. F.; Marques, J. J.; Guilherme, L. R. G.; Lima, J. M.; Lopes, A. S.; Alvares V. V. (ed.). Tópicos em ciência do solo. Viçosa: Sociedade Brasileira de Ciência do Solo, 2003. Cap.2, p.55-105.). Neste sentido, o trabalho objetivou avaliar a acumulação e a translocação de zinco em mudas de E. grandis, C.citriodora, E. saligna, E. dunnii cultivadas em solo contaminado com zinco e detectar possível tolerância entre as espécies estudadas.
Material e Métodos
O experimento foi conduzido em casa de vegetação do Viveiro Florestal da Universidade Federal de Santa Maria, campus de Frederico Westphalen - RS, entre os meses de outubro de 2011 e março de 2012 no delineamento experimental inteiramente casualizado, em arranjo fatorial (4 x 8), com doze repetições. O fator A se compunha de quatro espécies florestais da família Mirtaceae, sendo três do gênero Eucalyptus(E. grandis W. Hill ex Maid., E. saligna Sm e E. dunnii Maiden) e uma do gênero Corymbia(C. citriodora (Hook.) K.D. Hill & L.A.S. Johnson), e o fator D, oito doses de zinco (0, 140, 280, 420, 560, 700, 840 e 980 mg kg-1 de solo), aplicadas ao solo com uma solução de sulfato de zinco (ZnSO4.7H2O) antecedendo em 30 dias a semeadura das plantas.
As espécies florestais foram cultivadas em embalagem plástica com capacidade de 120 cm3 (unidade experimental), preenchida com Latossolo Vermelho destorroado e peneirado (malha de 4,0 mm), coletado na camada de 0 - 0,2 m, com pH água (1:1) de 5,1; 790 e 7,0 g dm-3 de argila e matéria orgânica, respectivamente; 1,5 e 20,0 mg dm-3 de fósforo e potássio disponíveis (extraído com a solução Mehlich-1), respectivamente; 4,8 cmolcdm-3de cálcio + magnésio trocáveis (extraído com KCl 1,0 mol L-1) e 1,1 mg dm-3 de zinco disponível (extraído com a solução HCl 0,1 mol L-1).
O pH do solo foi corrigido a 5,5 por meio da aplicação da mistura de carbonato de cálcio (CaCO3) e carbonato de magnésio (MgCO3) na relação molar 3:1 e monitorado durante 50 dias até sua estabilização. No momento da semeadura das espécies florestais foi realizada a adubação de base com aplicação de uma solução para proporcionar 150 g de N, 300 g de P2O5 e 100 g de K2O por m3 de substrato, conforme Gonçalves & Benedetti (2005)Gonçalves, J. L. M, Benedetti, V. Nutrição e fertilização florestal. 1.ed. Piracicaba: IPEF, 2005. 427p. e aos 30 e 60 dias após a emergência das plantas foi aplicada, em cobertura, uma solução contendo as mesmas quantidades equivalentes em Nitrogênio e Potássio à adubação de base. As fontes de nutriente utilizadas foram a ureia (45% de N), o fosfato de potássio e o cloreto de potássio para P e K.
A semeadura das espécies florestais foi realizada diretamente nas unidades experimentais usando-se quatro sementes e após a emergência procedeu-se ao raleio das plântulas deixando-se apenas uma planta. As plantas foram cultivadas por cinco meses sob três irrigações diárias mantendo-se o solo na capacidade de campo. As sementes das espécies florestais foram obtidas na FEPAGRO Florestas - Centro de Pesquisa em Florestas, Santa Maria - RS.
Os parâmetros avaliados foram altura de planta em cm, medida com régua graduada a partir do colo da muda até o meristema apical; diâmetro do colo em mm, medido com paquímetro digital (Digimess®); volume radicular em cm3, pelo deslocamento de água em proveta graduada; área foliar em cm2, pelo cálculo de imagens das folhas com câmera fotográfica digital de 12 megapixels pelo Software para Análise Foliar - AFSoft®; massa seca da parte aérea e radicular em g, após a separação da parte aérea e radicular na região do colo da planta, ambas as partes foram secadas em estufa a 60 °C, até massa constante e pesadas em balança analítica e teor de zinco na parte aérea e radicular, por meio da digestão úmida com HNO3 + HClO4 (3:1) e determinação por espectrofotometria de absorção atômica com chama de ar-acetileno (Miyazawa et al., 2009).
Com os teores de zinco na raiz (ZnR) e na parte aérea (ZnPA) no tratamento com a dose zero (d0) e nos tratamentos com as doses de 140 à 980 mg kg-1(dn) foi calculado o coeficiente de impacto do teor relativo de zinco (CITR) pela equação: CITR = (ZnRdn/ZnPAdn)/(ZnRd0/ZnPAd0). Com a quantidade de zinco acumulado na parte aérea (ZnAPA) e o total acumulado na planta (ZnAPL) foi calculado o índice de translocação de zinco (ITZn), expresso em percentagem: ITZn = (ZnAPA/ZnAPL) x 100, conforme proposto por Abichequier & Bohnen (1998)Abichequier, A. D.; Bohnen, H. Eficiência de absorção, translocação e utilização de fósforo por variedades de trigo. Revista Brasileira de Ciência do Solo, v.22, p.21-26, 1998. http://dx.doi.org/10.1590/S0100-06831998000100003
http://dx.doi.org/10.1590/S0100-06831998...
.
Os dados foram submetidos à análise da variância pelo teste F (p ≤ 0,05) e realizados os devidos desdobramentos a partir da indicação de interação significativa entre os fatores. Para o fator qualitativo (espécies) as médias foram comparadas pela diferença mínima significativa (DMS) do teste de Tukey (p ≤ 0,05) e para o fator quantitativo (doses de zinco), as médias foram ajustadas por equações de regressão polinomial (p ≤ 0,01 ou 0,05) usando-se o programa SISVAR (Ferreira, 2011Ferreira, D. F. Sisvar: A computer statistical analysis system. Ciência e Agrotecnologia, v.35, p.1039-1042, 2011. http://dx.doi.org/10.1590/S1413-70542011000600001
http://dx.doi.org/10.1590/S1413-70542011...
).
Resultados e Discussão
A análise da variância indicou interação significativa entre as espécies florestais e as doses de zinco aplicadas no solo (Tabelas 1 e 2). Nas quatro espécies florestais houve redução linear na massa seca da parte aérea com as doses de zinco e comparando os valores na dose zero e na dose de 980 mg dm-3, foram observadas reduções de 35, 56, 60 e 81% no C. citriodora, E.saligna, E. grandis e no E. dunnii, respectivamente, (Tabela 1) sendo o E. dunnii significativamente menor que os demais na maior dose deste metal (Tabela 2). Redução na matéria seca em mudas de E. maculata e E. urophylla em solo contaminado com zinco também foi encontrada por Soares et al. (2001) e em cultivo de E. urophylla, em solução nutritiva com doses crescentes do metal, por Ramos et al. (2009)Ramos, S.; Castro, E. M.; Carmo Pinto, S. I.; Faquin, V.; Oliveira, C.; Pereira, G. C. Uso do silício na redução da toxidez de zinco em mudas de eucalipto. Interciencia, v.34, p.189-194, 2009.. Esta redução pode estar relacionada à ação tóxica em que o zinco, em altas concentrações ocasiona no DNA das células das plantas menos tolerantes ao metal (Gichner et al., 2006Gichner, T.; Patková, Z.; Száková, J.; Demnerova, K. Toxicity and DNA damage in tobacco and potato plants growing on soil polluted with heavy metals. Ecotoxicology and Environmental Safety, v.65, p.420-426, 2006. http://dx.doi.org/10.1016/j.ecoenv.2005.08.006
http://dx.doi.org/10.1016/j.ecoenv.2005....
). Kabata-Pendias (2011)Kabata-Pendias, A. Trace elements in soils and plants. 4.ed. Boca Raton: CRC Press/Taylor & Francis Group, 2011. 548p.relataram que teores totais de zinco no solo acima de 140 mg kg-1 podem causar danos fisiológicos e limitar o crescimento das plantas pelas reações do metal aos grupos de fosfatos e grupos ativos de ADP ou ATP.
Equações de regressão da altura de plantas, diâmetro do colo, volume radicular, área foliar, massa seca e teor de zinco na parte aérea e radicular das mudas de E. grandis, C. citriodora, E. saligna e E. dunni após cinco meses da semeadura com adição de doses crescentes de zinco e o respectivo percentual de redução ou aumento (PRA) com a dose máxima de zinco aplicada
Altura de planta, diâmetro do caule, volume radicular, área foliar, matéria seca da parte aérea e radicular, teor de zinco na parte aérea e nas raízes das mudas de E. grandis, C. citriodora, E. saligna e E. dunnii cultivadas em solo com doses crescentes de zinco
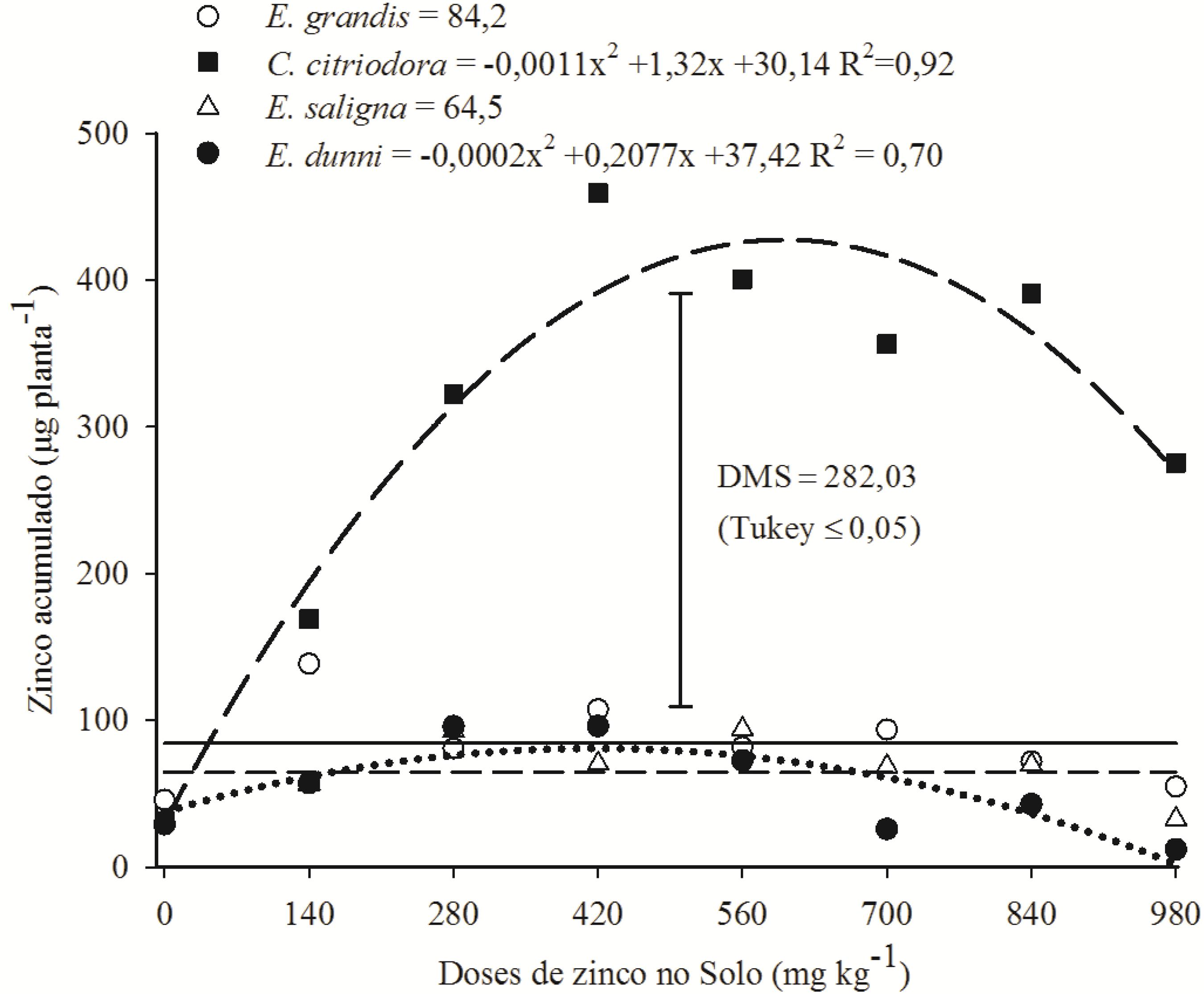
Embora tenha ocorrido redução de matéria seca da parte aérea, o C. citriodora manifestou aumento na acumulação de zinco com 428 µg planta-1 em 602 mg kg-1 de zinco (Figura 1). Referido aumento indica que esta espécie apresenta alta capacidade de acumulação de zinco, em média de 14 vezes em relação às demais. No E. dunnii, a acumulação de zinco na parte aérea da planta foi até a dose de 519 mg kg-1, mas com máximo de 91 µg planta-1, representando aumento de apenas 2,4 vezes. No E. grandis e E. saligna não houve aumento na acumulação de zinco na parte aérea com as doses aplicadas no solo com médias de 84 e 65 µg planta-1, respectivamente. Diferentes capacidades de absorção de zinco entre espécies de eucalipto também foram observadas por Assareh et al. (2008)Assareh, M. H.; Shariat, A.; Ghamari-Zare, A. Seedling response of three Eucalyptus species to copper and zinc toxic concentrations. Caspian Journal of Environmental Sciences, v.6, p.97-103, 2008. e respostas distintas entre E. maculata e E. urophylla com a elevação da dose do metal no solo foram relatadas por Soares et al. (2001)Soares, C. R. F. S.; Grazziotti, P. H.; Siqueira, J. O.; Carvalho, J. G.; Moreira, F. M. S. Toxidez de zinco no crescimento e nutrição de Eucalyptus maculata e Eucalyptus urophylla em solução nutritiva. Pesquisa Agropecuária Brasileira, v.36, p.339-348, 2001. http://dx.doi.org/10.1590/S0100-204X2001000200018
http://dx.doi.org/10.1590/S0100-204X2001...
nas quais as duas espécies foram sensíveis à elevação do teor de zinco.
Quantidade de zinco acumulado na massa seca da parte aérea das mudas de E. grandis, C. citriodora, E. saligna e E. dunni após cinco meses da semeadura com adição de doses crescentes de zinco
O aumento na acumulação de zinco na parte aérea das mudas de C. citriodora e E. dunnii e a manutenção da quantidade acumulada no E. grandis e E.saligna, mesmo com a redução de matéria seca, estão relacionados ao acréscimo da concentração de zinco no tecido foliar (Tabelas 1 e 2), sendo no C. citriodorasignificativamente maiores doses de cobre (Tabela 2). A análise de regressão evidencia que a concentração máxima de zinco no tecido da parte aérea atingiu 766, 247, 200 e 166 mg kg-1no C. citriodora, E. grandis, E.saligna e E. dunnii,respectivamente. Observa-se que somente no C. citriodora a concentração está acima de 300 mg kg-1, citada por Broadley et al. (2007)Broadley, M. R.; White, P. J.; Hammond, J. P.; Zelko, I.; Lux, A. Zinc in plants. New Phytologist, v.173, p.677-702, 2007. http://dx.doi.org/10.1111/j.1469-8137.2007.01996.x
http://dx.doi.org/10.1111/j.1469-8137.20...
como limite para não causar fitotoxidade às plantas. As demais espécies apresentaram, além da menor concentração de zinco na parte aérea, maiores reduções de matéria seca com as doses do metal indicando ser menos tolerante ao zinco.
As doses de zinco também induziram redução linear na altura das mudas deE.saligna, E. grandis e C. citriodora, na ordem de 44, 43 e 34%, respectivamente (Tabelas 1 e 2). O E. dunnii, apesar do incremento na altura até 53 mg kg-1, apresentou 68% de redução na altura com a dose máxima de zinco aplicada sendo significativamente menor que as demais espécies (Tabela 2). Incrementos na altura de plantas com adição de pequenas doses de metal também foi observado em E. dunniiem comparação ao E. globulus, E.grandis e E. saligna, justificado pela maior exigência do nutriente às funções metabólicas, atuando sobretudo como componente de uma variedade de enzimas (Freddo et al., 1999Ferreira, D. F. Sisvar: A computer statistical analysis system. Ciência e Agrotecnologia, v.35, p.1039-1042, 2011. http://dx.doi.org/10.1590/S1413-70542011000600001
http://dx.doi.org/10.1590/S1413-70542011...
).
O diâmetro do colo foi reduzido linearmente no E. grandis e C. citriodora e, de forma quadrática negativa, no E. saligna e E. dunnii, em função da aplicação de doses crescentes de zinco (Tabela 1). Pinto et al. (2009)Pinto, S. I. C.; Ramos, S. J.; Araujo, J. L.; Faquin, V.; Novais, C. B.; Silva, K.; Furtini Neto, A. E.. Silício como amenizador da fitotoxicidade de zinco em plantas jovens de Eucalyptus urophylla cultivadas em solução nutritiva. Revista Árvore, v.33, p.1005-1014, 2009. verificaram redução no diâmetro do colo de mudas de E. urophylla cultivadas em solução nutritiva submetidas a doses maiores que 100 mmol L-1 de zinco. Deste modo, a probabilidade de sobrevivência das mudas de eucalipto em solos contaminados com zinco pode ser baixa.
O volume radicular não foi afetado pelas doses de zinco aplicadas no solo no E. grandis, enquanto o C. citriodora, E. saligna e E. dunnii manifestaram redução em 32, 30 e 93%, respectivamente (Tabelas 1 e 2). O E. dunnii também apresentou a maior redução na área foliar (72%) (Tabela 2). O maior efeito fitotóxico causado pelas doses de zinco no E. dunnii pode estar relacionado à perturbação dos processos fisiológicos, afetando a mitose e favorecendo a morte celular das raízes reduzindo o desenvolvimento radicular (Hooda, 2010)Hooda, P. S. Trace elements in soils. 1.ed. United Kingdom: Wiley-Blackwell, 2010. 616p. http://dx.doi.org/10.1002/9781444319477
http://dx.doi.org/10.1002/9781444319477...
, bem como a indução da clorose por deficiência de ferro, decréscimo na quantidade de clorofila a e b ou por inibição direta dos processos fotoquímicos devido à toxidez de zinco nas folhas (Tsonev & Lidon, 2012Tsonev, T.; Lidon, F. J. C. Zinc in plants - An overview. Emirates Journal of Food and Agriculture, v.24, p.322-333, 2012.). Quanto ao C. citriodora, é possível a existência de mecanismos de destoxificação de metais pesados na parte aérea desta espécie conforme relatado por Grazziotti et al. (2003)Grazziotti, P. H.; Siqueira, J. O.; Moreira, F. M. S. Espécies arbóreas e ectomicorrizas em relação ao excesso e metais pesados. In: Curi, R. F.; Marques, J. J.; Guilherme, L. R. G.; Lima, J. M.; Lopes, A. S.; Alvares V. V. (ed.). Tópicos em ciência do solo. Viçosa: Sociedade Brasileira de Ciência do Solo, 2003. Cap.2, p.55-105..
A redução da matéria seca da parte aérea e das raízes e o volume radicular com as doses de zinco foram menores que 50% no C. citriodora e maiores que 80% no E. dunnii. Com exceção do diâmetro do colo, o E. dunnii foi a espécie que apresentou as maiores reduções na altura de plantas, volume radicular, área foliar e massa seca da parte aérea e radicular (Tabelas 1 e 2).
A interferência das doses de zinco aplicadas no solo de forma diferenciada na inibição do crescimento em altura, área foliar, massa seca e volume radicular nas quatro espécies florestais estudadas, pode estar relacionada ao índice de translocação de zinco. As equações de regressão da Figura 2A indicam aumento no índice de translocação no E. grandis e C. citriodora e E. saligna, até as doses de 515,4; 549,7 e 569 mg kg-1, destacando-se o C. citriodora com maior índice independente da dose de zinco. Índice de translocação baixo pode indicar a existência de mecanismos que restringem o contaminante aos tecidos das raízes para evitar concentrações tóxicas na parte aérea (Branzini et al., 2012Branzini, A.; González, R. S.; Zubillaga, M. Absorption and translocation of copper, zinc and chromium by Sesbania virgata. Journal of Environmental Management, v.102, p.50-54, 2012. http://dx.doi.org/10.1016/j.jenvman.2012.01.033
http://dx.doi.org/10.1016/j.jenvman.2012...
), enquanto índices mais elevados demonstram a existência de mecanismos fisiológicos que permitem altas concentrações de metais pesados na parte aérea das plantas (Lin & Aarts, 2012Lin, Y. F.; Aarts, M. G. M. The molecular mechanism of zinc and cadmium stress response in plants. Cellular and Molecular Life Sciences, v.69, p.3187-3206, 2012. http://dx.doi.org/10.1007/s00018-012-1089-z
http://dx.doi.org/10.1007/s00018-012-108...
).
Índice de translocação de zinco (A) e coeficiente de impacto do teor relativo de zinco - CITR (B) nas mudas de E. grandis, C. citriodora, E. saligna e E. dunni após cinco meses da semeadura com adição de doses crescentes de zinco
Silveira et al. (2003)Silveira, M. L. A.; Alleoni, L. R. F.; Guilherme, L. R. G. Biosolids and heavy metals in soils. Scientia Agricola, v.60, p.793-806, 2003. http://dx.doi.org/10.1590/S0103-90162003000400029
http://dx.doi.org/10.1590/S0103-90162003...
, evidenciaram alta retenção de zinco nas raízes de E. grandis, reduzindo sua translocação para a parte aérea e, em contrapartida, minimizando efeitos danosos nas folhas. Espécies tolerantes podem reduzir os efeitos deletérios de teores excessivos de zinco na parte aérea imobilizando ou compartimentalizando nas raízes (Saraswat & Rai, 2011Saraswat, S.; Rai, J. P. N. Complexation and detoxification of Zn and Cd in metal accumulating plants. Reviews in Environmental Science and BioTechnology, v.10, p.327-339, 2011. http://dx.doi.org/10.1007/s11157-011-9250-y
http://dx.doi.org/10.1007/s11157-011-925...
). No caso do E. dunnii, o baixo índice de translocação resultou em elevada concentração na massa seca das raízes (2714 mg kg-1) com a aplicação de 980 mg kg-1 de zinco no solo (Tabela 1) prejudicando o crescimento das mudas.
O coeficiente de impacto do teor relativo de zinco aumentou significativamente no E. dunnii, reduziu no E., e permaneceu menor que uma unidade no E. grandis e C. citriodora com as doses do metal aplicadas no solo (Figura 2B). Valores do CITR maiores que uma unidade indica maiores teores de zinco nas raízes que na parte aérea e é um parâmetro que mede a capacidade de limitar a translocação de zinco absorvida pelas raízes das espécies florestais (Marques et al., 2000Marques, T. C. L. L. S. M.; Moreira, F. M. S.; Siqueira, J. O. Crescimento e teores de metais em mudas de espécies arbóreas tropicais em solo contaminado com metais pesados. Pesquisa Agropecuária Brasileira, v.35, p.121-132, 2000. http://dx.doi.org/10.1590/S0100-204X2000000100015
http://dx.doi.org/10.1590/S0100-204X2000...
). A acumulação de zinco nas raízes pode reduzir o crescimento das plantas pela menor capacidade de absorção de água e nutrientes (Pereira et al., 2013Pereira, A. C. C.; Amaral Sobrinho, N. M. B .do; Sampaio Júnior, J.; Oliveira, J. A.; Santos, F. S. dos; Mazur, N. Comportamento da Cordia africana Lam. cultivada em solo contaminado por metais pesados e tratado com materiais amenizantes. Ciência Florestal, v.23, p.329-336, 2013. http://dx.doi.org/10.5902/1980509810544
http://dx.doi.org/10.5902/1980509810544...
). Deste modo, o coeficiente de impacto no teor relativo de zinco das mudas do C. citriodora indica aptidão à fito acumulação-extração em solos contaminados com o metal. Futuros estudos em condições de campo poderão comprovar se esta espécie florestal apresenta alta capacidade de acumular zinco e de remover o metal em áreas contaminadas.
Conclusões
1. O aumento das doses de zinco reduz em 35, 56, 60 e 81% a massa seca da parte aérea das mudas de C. citriodora, E.saligna, E. grandis e E. dunnii, respectivamente.
2. O E. dunnii é mais sensível às doses de zinco aplicadas ao solo em relação ao E. grandis, C. citriodora e E. saligna.
3. O C. citriodora apresenta aumento na acumulação de zinco na parte aérea, aumento no índice de translocação e redução do coeficiente de impacto do teor relativo com as doses aplicadas no solo, indicando maior tolerância em relação às demais em solos contaminados.
Agradecimentos
Ao Conselho Nacional de Desenvolvimento Científico e Tecno-lógico (CNPq) à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes) pela concessão das bolsas e à FAPERGS.
Literatura Citada
- Abichequier, A. D.; Bohnen, H. Eficiência de absorção, translocação e utilização de fósforo por variedades de trigo. Revista Brasileira de Ciência do Solo, v.22, p.21-26, 1998. http://dx.doi.org/10.1590/S0100-06831998000100003
» http://dx.doi.org/10.1590/S0100-06831998000100003 - Assareh, M. H.; Shariat, A.; Ghamari-Zare, A. Seedling response of three Eucalyptus species to copper and zinc toxic concentrations. Caspian Journal of Environmental Sciences, v.6, p.97-103, 2008.
- Basso, C. J.; Ceretta, C. A.; Flores, E. M. M.; Girotto, E. Teores totais de metais pesados no solo após aplicação de dejeto líquido de suínos. Ciência Rural, v.42, p.653-659, 2012. http://dx.doi.org/10.1590/S0103-84782012000400012
» http://dx.doi.org/10.1590/S0103-84782012000400012 - Branzini, A.; González, R. S.; Zubillaga, M. Absorption and translocation of copper, zinc and chromium by Sesbania virgata Journal of Environmental Management, v.102, p.50-54, 2012. http://dx.doi.org/10.1016/j.jenvman.2012.01.033
» http://dx.doi.org/10.1016/j.jenvman.2012.01.033 - Broadley, M. R.; White, P. J.; Hammond, J. P.; Zelko, I.; Lux, A. Zinc in plants. New Phytologist, v.173, p.677-702, 2007. http://dx.doi.org/10.1111/j.1469-8137.2007.01996.x
» http://dx.doi.org/10.1111/j.1469-8137.2007.01996.x - CONAMA - Conselho Nacional do Meio Ambiente. Resolução Nº 420 de 28 de dezembro de 2009. Dispõe sobre critérios e valores orientadores de qualidade do solo quanto à presença de substâncias químicas e estabelece diretrizes para o gerenciamento ambiental de áreas contaminadas por essas substâncias em decorrência de atividades antrópicas. Diário Oficial da República Federativa do Brasil, Brasília, DF, 31 de dezembro de 2009. <http://www.mma.gov.br/port/conama/res/res09/res42009.pdf>. 21 Jul. 2014.
» http://www.mma.gov.br/port/conama/res/res09/res42009.pdf - Ferreira, D. F. Sisvar: A computer statistical analysis system. Ciência e Agrotecnologia, v.35, p.1039-1042, 2011. http://dx.doi.org/10.1590/S1413-70542011000600001
» http://dx.doi.org/10.1590/S1413-70542011000600001 - Freddo, A.; Foelkel, C. E. B.; Frizzo, S. M. B.; Silva, M. C. M. Elementos minerais em madeiras de eucaliptos e acácia negra e sua influência na indústria de celulose kraft branqueada. Ciência Florestal, v.9, p.193-209, 1999.
- García, G.; Faz, Á.; Cunha, M. Performance of Piptatherum miliaceum (Smilo grass) in edaphic Pb and Zn phytoremediation over a short growth period. International Biodeterioration & Biodegradation, v.54, p.245-250. 2004. http://dx.doi.org/10.1016/j.ibiod.2004.06.004
» http://dx.doi.org/10.1016/j.ibiod.2004.06.004 - Gichner, T.; Patková, Z.; Száková, J.; Demnerova, K. Toxicity and DNA damage in tobacco and potato plants growing on soil polluted with heavy metals. Ecotoxicology and Environmental Safety, v.65, p.420-426, 2006. http://dx.doi.org/10.1016/j.ecoenv.2005.08.006
» http://dx.doi.org/10.1016/j.ecoenv.2005.08.006 - Gonçalves, J. L. M, Benedetti, V. Nutrição e fertilização florestal. 1.ed. Piracicaba: IPEF, 2005. 427p.
- Grazziotti, P. H.; Siqueira, J. O.; Moreira, F. M. S. Espécies arbóreas e ectomicorrizas em relação ao excesso e metais pesados. In: Curi, R. F.; Marques, J. J.; Guilherme, L. R. G.; Lima, J. M.; Lopes, A. S.; Alvares V. V. (ed.). Tópicos em ciência do solo. Viçosa: Sociedade Brasileira de Ciência do Solo, 2003. Cap.2, p.55-105.
- Harwood, C. New Introductions: Doing it right. In: Walker, J. (ed.) Developing a eucalypt resource. Learning from Australia and Elsewhere. Christchurch: Wood Technology Research Centre, University of Canterbury, 2011. p.43-54..
- Hooda, P. S. Trace elements in soils. 1.ed. United Kingdom: Wiley-Blackwell, 2010. 616p. http://dx.doi.org/10.1002/9781444319477
» http://dx.doi.org/10.1002/9781444319477 - Kabata-Pendias, A. Trace elements in soils and plants. 4.ed. Boca Raton: CRC Press/Taylor & Francis Group, 2011. 548p.
- Lin, Y. F.; Aarts, M. G. M. The molecular mechanism of zinc and cadmium stress response in plants. Cellular and Molecular Life Sciences, v.69, p.3187-3206, 2012. http://dx.doi.org/10.1007/s00018-012-1089-z
» http://dx.doi.org/10.1007/s00018-012-1089-z - Magalhães, M. O. L.; Amaral Sobrinho, N. M. B. do; Santos, F. S.; Mazur, N. Potencial de duas espécies de eucalipto na fitoestabilização de solo contaminado com zinco. Revista Ciência Agronômica, v.42, p.805-812, 2011. http://dx.doi.org/10.1590/S1806-66902011000300029
» http://dx.doi.org/10.1590/S1806-66902011000300029 - Marques, T. C. L. L. S. M.; Moreira, F. M. S.; Siqueira, J. O. Crescimento e teores de metais em mudas de espécies arbóreas tropicais em solo contaminado com metais pesados. Pesquisa Agropecuária Brasileira, v.35, p.121-132, 2000. http://dx.doi.org/10.1590/S0100-204X2000000100015
» http://dx.doi.org/10.1590/S0100-204X2000000100015 - Miyazawa, M.; Pavan, M. A.; Muraoka, T.; Carmo, C. A. F. S. de; Melo, W.J.de. Parte 2/Capítulo 1 - Análise química de tecido vegetal. In: Silva, F. C. (ed.). Manual de análises químicas de solos, plantas e fertilizantes. Brasília: Embrapa Informação Tecnológica, 2009. Cap.1, p.193-233.
- Pereira, A. C. C.; Amaral Sobrinho, N. M. B .do; Sampaio Júnior, J.; Oliveira, J. A.; Santos, F. S. dos; Mazur, N. Comportamento da Cordia africana Lam. cultivada em solo contaminado por metais pesados e tratado com materiais amenizantes. Ciência Florestal, v.23, p.329-336, 2013. http://dx.doi.org/10.5902/1980509810544
» http://dx.doi.org/10.5902/1980509810544 - Pinto, S. I. C.; Ramos, S. J.; Araujo, J. L.; Faquin, V.; Novais, C. B.; Silva, K.; Furtini Neto, A. E.. Silício como amenizador da fitotoxicidade de zinco em plantas jovens de Eucalyptus urophylla cultivadas em solução nutritiva. Revista Árvore, v.33, p.1005-1014, 2009.
- Ramos, S.; Castro, E. M.; Carmo Pinto, S. I.; Faquin, V.; Oliveira, C.; Pereira, G. C. Uso do silício na redução da toxidez de zinco em mudas de eucalipto. Interciencia, v.34, p.189-194, 2009.
- Santana, R. C.; Júlio, N. F. B.; Neves, C. L. Biomassa e conteúdo de nutrientes de procedências de Eucalyptus grandis e Eucalyptus saligna em alguns sítios florestais do Estado de São Paulo. Scientia Forestalis, v.56, p.155-169, 1999.
- Saraswat, S.; Rai, J. P. N. Complexation and detoxification of Zn and Cd in metal accumulating plants. Reviews in Environmental Science and BioTechnology, v.10, p.327-339, 2011. http://dx.doi.org/10.1007/s11157-011-9250-y
» http://dx.doi.org/10.1007/s11157-011-9250-y - Silveira, M. L. A.; Alleoni, L. R. F.; Guilherme, L. R. G. Biosolids and heavy metals in soils. Scientia Agricola, v.60, p.793-806, 2003. http://dx.doi.org/10.1590/S0103-90162003000400029
» http://dx.doi.org/10.1590/S0103-90162003000400029 - Soares, C. R. F. S.; Grazziotti, P. H.; Siqueira, J. O.; Carvalho, J. G.; Moreira, F. M. S. Toxidez de zinco no crescimento e nutrição de Eucalyptus maculata e Eucalyptus urophylla em solução nutritiva. Pesquisa Agropecuária Brasileira, v.36, p.339-348, 2001. http://dx.doi.org/10.1590/S0100-204X2001000200018
» http://dx.doi.org/10.1590/S0100-204X2001000200018 - Tsonev, T.; Lidon, F. J. C. Zinc in plants - An overview. Emirates Journal of Food and Agriculture, v.24, p.322-333, 2012.
- Zhuang, G.; Hu, T.; Guo, H.; Liu, J.; Chen, Z.; Yang, X. Comparision on cold resistance of Eucalyptus from different provenances. Eucalypt Science & Technology, v.27, p.23-35, 2010.
Datas de Publicação
-
Publicação nesta coleção
Nov 2015
Histórico
-
Aceito
22 Maio 2015