Resumos
O objetivo do presente trabalho foi avaliar o produto iônico do biovidro 60S (BV60S) na diferenciação osteogênica de células-tronco mesenquimais de origem adiposa (CTM-AD) de cães. As CTM-AD foram diferenciadas sem OSTe com o produto iônico (PI OST) por sete, 14 e 21 dias. Avaliou-se o MTT, a fosfatase alcalina (FA), o colágeno, mineralização e as expressões de osterix (OSX), sialoproteína óssea (BSP), osteonectina (ON) e osteocalcina (OC). O grupo PI OST mostrou menor conversão de MTT aos sete dias e maior conversão aos 21 dias. A atividade de FA foi maior no grupo OST, aos 14 e 21 dias. A síntese de colágeno foi maior no grupo OST aos sete e 21 dias. Verificou-se maior área mineralizada no grupo PI OST em todos os tempos. Não houve diferenças nas expressões de OSX e OC entre os grupos. Observou-se maior expressão de BSP no grupo PI OST, aos 14 e 21 dias. A expressão de ON foi maior no grupo OST aos 14 dias. Concluiu-se que o produto iônico do BV60S favorece a osteogênese in vitro de CTM-AD de cães.
cão; células-tronco; biomateriais; diferenciação osteogênica
The aim was to evaluate the ionic product of 60S bioglass (BV60S) in osteogenic differentiation of mesenchymal stem cells from adipose tissue (ADMSCs) in dogs. ADMSCs were differentiated without the ionic product (OST) and with the ionic product (PI-OST) for 7, 14 and 21 days. We evaluated the MTT, alkaline phosphatase (ALP), collagen mineralization and expressions of osterix (OSX), bone sialoprotein (BSP), osteonectin (ON) and osteocalcin (OC). The PI-OST group had a lower MTT conversion to 7days and higher conversion at 21 days. The ALP activity was higher in the OST group at 14 and 21 days. Collagen synthesis was higher in the OST group at 7 and 21 days. A higher mineralized area in the PI-OST group was observed at all times. There were no differences in expressions of OSX and OC between groups. We observed increased expression of BSP in the PI-OST group at 14 and 21 days. The expression of ON was higher in the OST group at 14 days. It was concluded that the ionic product of BV60S promotes in vitro osteogenesis of MSC-AD from dogs.
dog; stem cells; biomaterials; osteogenic differentiation
INTRODUÇÃO
Entre os principais biomateriais utilizados para substituição óssea, os biovidros são considerados os mais bioativos e favoráveis à regeneração óssea (Christodoulou et al., 2006CHRISTODOULOU, I.; BUTTERY, L.D.; TAI, G. et al. Characterization of human fetal osteoblast by microarray analysis following stimulation with 58S bioactive Gel-Glass ionic dissolution products. J. Biomed. Mater. Res. B. Appl. Biomater., v.77, p.431-446, 2006.). Sua composição química e o grau de cristalinidade podem variar e determinam a maior ou menor dissolução após a implantação no organismo, o que, consequentemente, altera seu efeito biológico (Hoppe et al., 2011HOPPE, A.; GULDAL, N.S.; BOCCACCINI, A.R. A review of the biological response to ionic products from bioactive glasses and glass-ceramics. Biomaterials, v.32, p.2757-2774, 2011.). Acredita-se que o efeito biológico dos biovidros seja mediado principalmente pelos íons cálcio (Hoppe et al., 2011HOPPE, A.; GULDAL, N.S.; BOCCACCINI, A.R. A review of the biological response to ionic products from bioactive glasses and glass-ceramics. Biomaterials, v.32, p.2757-2774, 2011.) e pelo silício (Shie et al., 2011SHIE, M.Y.; DING, S.J.; CHANG, H.C. The role of silicon in osteoblast-like cell proliferation and apoptosis. Acta Biomater., v.7, p.2604-2614, 2011.). Já foi comprovado que esses íons podem favorecer a proliferação (Barradas et al., 2012BARRADAS, A.M.C.; FERNANDES, H.A.M.; GROEN, N. et al. A calcium-induced signaling cascade leading to osteogenic differentiation of human bone marrow-derived mesenchymal stromal cells. Biomaterials, v.33, p.3205-3215, 2012.; McCullen et al., 2010MCCULLEN, S.D.; ZHAN, J.; ONORATO, M.L. et al. Effect of varied ionic calcium on human adipose-derived stem cell mineralization. Tissue Eng A, v.16, p.1971-1981, 2010.) e a diferenciação osteogênica in vitro (Jung e Park, 2010JUNG, G.Y.; PARK, Y.J. Effects of HA released calcium ion on osteoblast differentiation. J Mater Sci: Mater Med, v.21, p.1649-1654, 2010.; McCullen et al., 2010MCCULLEN, S.D.; ZHAN, J.; ONORATO, M.L. et al. Effect of varied ionic calcium on human adipose-derived stem cell mineralization. Tissue Eng A, v.16, p.1971-1981, 2010.). Porém, não se sabe ao certo qual a composição química ideal do biovidro para que, quando implantado no organismo, libere a combinação e a concentração ideal de íons para maximização do processo de regeneração óssea. Em um estudo in vitro com osteoblastos de ratos, o biovidro 60S mostrou taxas satisfatórias de liberação de íons cálcio e silício, que favoreceram a proliferação celular (Valério et al., 2004VALÉRIO, P.; PEREIRA, M.M.; GOES, A.M. et al. The effect of ionic products from bioactive glass dissolution on osteoblast proliferation and collagen production. Biomaterials, v.25, p.2941-2948, 2004.), mas nada se sabe dos efeitos desse biomaterial sobre a diferenciação osteogênica de células-tronco mesenquimais de cães. Portanto, o objetivo do presente estudo foi avaliar o efeito do produto iônico do biovidro 60S na diferenciação osteogênica de células-tronco mesenquimais extraídas do tecido adiposo (CTM-AD) de cães, com vistas à futura utilização desse biomaterial associado às CTM-AD para tratamento de defeitos ósseos em cães.
MATERIAL E MÉTODOS
Este estudo foi realizado de acordo com as normas internacionais de bem-estar animal após aprovação pelo Comitê de Ética em Experimentação Animal da UFMG (protocolo nº. 157/2009).
Para obtenção, cultivo e expansão das CTM-AD, utilizaram-se três cães hígidos, machos, sem raça definida, com dois anos de idade e massa corporal média 18kg. Os cães receberam 1mg/kg IM de xilazina (Calmiun, Agener, Brasil) e 15mg/kg IM de quetamina (Vetanarcol, Konig, Brasil) para indução anestésica e preparação para cirurgia. O propofol (Fresofol, Fresenius Kabi, Brasil) (3mg/kg IV) foi utilizado para intubação e manutenção anestésica. Para analgesia, utilizou-se meloxicam (Maxicam, Ouro Fino, Brasil) (0,2mg/kg IM) a cada 24 horas, durante três dias. O tecido adiposo foi coletado da região glútea subcutânea, obtendo-se 1cm3de cada animal, o que totalizou 3cm3 de amostra final. Em seguida, as amostras foram encaminhadas ao Núcleo de Células-Tronco da Escola de Veterinária da UFMG, onde as CTM-AD foram extraídas e cultivadas segundo o protocolo descrito por Vieira et al. (2010). A amostra de tecido adiposo foi lavada com PBS 0,15 molar e digerida em 20mL de solução de colagenase B (Roche, Alemanha) 0,1%P/V. Para digestão, a amostra foi fragmentada em partículas de 2mm e incubada por 45 minutos em estufa a 37oC e 5% de CO2. Em seguida, a amostra foi centrifugada por 10 minutos a 1400rpm, o sobrenadante foi descartado, e o pellet plaqueado e cultivado em garrafa T75 com meio basal [DMEM com baixa glicose (Gibco, USA) enriquecido com gentamicina (60μg/L), penicilina (100U/mL), estreptomicina (100μg/mL), anfotericina (25μg/mL) (PSA, Sigma-Aldrich, USA)] enriquecido 10% de soro fetal bovino (Soralis, Brasil). As garrafas foram incubadas em estufa a 37oC e 5% de CO2 e, após 48h, as células foram lavadas com PBS 0,15 molar. O meio de cultivo foi trocado duas vezes por semana e, assim que eram atingidos 80 a 90% de confluência, as células eram repicadas.
Para obtenção do produto iônico (PI), foi utilizado o biovidro 60S de composição molar 4% P2O5, 36% CaO e 60% SiO2 produzido pelo método descrito por Pereira et al. (2005)PEREIRA, M.M.; JONES, J.R.; OREFICE, R.L.; et al. Preparation of bioactive glass-polyvinil alcohol hybrid foams by the sol-gel method. J Mater Sci Mater Med., v.16, p.1045-1050, 2005.. A amostra foi moída em um gral de quartzo, e foi utilizada a fração com granulometria menor que 137µm. O biomaterial foi, então, tratado termicamente na mufla a 700◦C por seis horas. O produto iônico foi obtido adicionando-se 6g do biomaterial em 1L de meio basal, a mistura foi homogeneizada e incubada por 12 horas a 6◦C. Transcorrido o tempo de incubação, a suspensão foi filtrada em membrana de 22µm, e o pH normalizado para 7.2, obtendo-se o produto iônico do biovidro 60S.
No terceiro repique, as CTM-AD foram distribuídas nos grupos: OST - formado pelas CTM-AD em meio osteogênico [meio basal enriquecido com ácido ascórbico (50μg/mL), ß-glicerofosfato (10mM) (Sigma, USA), dexametasona (0,1μM) (Aché, Brasil) e 10% de soro fetal bovino] e PI OST - formado pelas CTM-AD em meio osteogênico com produto iônico [produto iônico enriquecido com ácido ascórbico (50μg/mL), ß-glicerofosfato (10mM), dexametasona (0,1μM) e 10% de soro fetal bovino].
As CTM-AD foram cultivadas em quadruplicata a 37oC e 5% de CO2 por sete, 14 e 21 dias com OST ou PI OST. Transcorridos esses períodos, avaliaram-se em cada grupo a conversão do MTT, a atividade da fosfatase alcalina (FA), a síntese de colágeno, a área mineralizada por campo e as expressões relativas de osterix (OSX), sialoproteina óssea (BSP), osteonectina (ON) e osteocalcina (OC) por RT-PCR em tempo real.
Para o teste de conversão do MTT, as CTM-AD de cada grupo foram cultivadas separadamente em placas de 24 poços com OST ou PI OST. Ao término de cada período de avaliação, o meio de cada poço foi substituído por 210μL de meio basal e 170μL de MTT (5mg/mL) (Invitrogen, USA). A placa foi incubada por duas horas em estufa a 37oC e 5% de CO2. Os cristais de formazan foram observados ao microscópio antes do acréscimo de 210μL de SDS (sódio dodecil sulfato)-10% HCl, que permaneceu overnight em estufa a 37oC e 5% de CO2. Posteriormente, 100μL de cada poço foram transferidos para placas de 96 poços para leitura em espectrofotômetro com comprimento de onda de 595nm.
Para avaliação da atividade da FA, as CTM-AD de cada grupo foram cultivadas separadamente em placas de 24 poços com OST ou PI OST. Ao término de cada período, as culturas foram lavadas com PBS (0,15 molar). Em cada poço, foram acrescentados 200μL de solução de BCIT/NBT (Zymed Laboratories, USA). As amostras foram incubadas por duas horas na estufa a 37oC e 5% de CO2 e observadas ao microscópio óptico antes do acréscimo de 200μL de SDS-10% HCl. Essas amostras permaneceram overnight em estufa a 37oC e 5% de CO2. Posteriormente, 100μL de cada poço foram transferidos para placas de 96 poços para leitura em espectrofotômetro com comprimento de onda de 595nm.
Para avaliação da síntese de colágeno, as CTM-AD de cada grupo foram cultivadas separadamente em placas de 24 poços com OST ou PI OST. Ao término de cada período, as culturas foram lavadas com PBS (0,15 molar) e fixadas com Bouin. As placas foram lavadas com água osmose reversa e secas para posterior coloração com Sirius Redpor 30 minutos. O excesso do corante foi removido, e as células foram lavadas com solução de HCl 0,01N e secas. Posteriormente, foram adicionados 300μL de NaOH 0,5M, e a placa foi incubada por 30 minutos. Em seguida, 100μL de cada poço foram transferidos para placas de 96 poços para leitura em espectrofotômetro com comprimento de onda de 540nm.
Para a avaliação da porcentagem de matriz mineralizada por campo, as CTM-AD de cada grupo foram cultivadas separadamente em placas de seis poços com lamínulas (Sarstedt, USA), com OST ou PI OST. Após cada período de avaliação, as CTM-AD foram fixadas com álcool 70% por 24 horas e coradas pelo método de von Kossa. A porcentagem de matriz mineralizada por campo foi determinada com o auxílio de uma ocular micrométrica contendo uma gratícula com 121 pontos, em 25 campos, com objetiva de 4×.
Como controle positivo da diferenciação osteogênica, foi utilizada uma cultura primária de osteoblastos caninos (Abcan, USA), que foi descongelada conforme protocolo do fabricante. Estes foram cultivados em garrafas T75, com os mesmos meios e sob as mesmas condições das CTM-AD. No terceiro repique após obtenção de 80 a 90% de confluência, as culturas de osteoblastos foram utilizadas para extração do RNA total e posterior análise da expressão de OSX, BSP, ON e OC pela técnica de RT-PCR em tempo real.
Para a quantificação relativa dos transcritos gênicos para OSX, BSP, ON e OC por RT-PCR em tempo real, as CTM-AD de cada grupo foram cultivadas em quadruplicata em garrafas T25 com OST ou PI OST. Ao término de cada período de avaliação, extraiu-se o RNA total das culturas de cada garrafa com o emprego do Trizol (Invitrogen, USA) seguindo o protocolo do fabricante. O RNA foi solubilizado em água DEPC (Invitrogen, USA) livre de RNAse e imediatamente armazenado a -80ºC. A concentração de RNA foi determinada pela leitura da absorbância a 260/280nm, por espectrofotometria. Foram realizadas as reações de transcrição reversa utilizando-se Kit SuperScriptTM III Platinum(r) Two-Step (Invitrogen, USA). Foi usado 1µg de RNA total para a síntese de cDNA com um volume final de 20µL. As reações de PCR foram feitas em tempo real, utilizando-se 2µg de cDNA, 5pM de cada iniciador e 12,5µL do reagente Sybr Green em um volume final de 25µL de reação por poço, no aparelho 7500 Real Time PCR System (Applied Biosystems, USA). Os parâmetros utilizados para amplificação foram: 50°C por 120 segundos, 95°C por 150 segundos e 45 ciclos, 95°C por 15 segundos e 60°C por 30 segundos. Os iniciadores foram pesquisados na literatura ou delineados com base na sequência do mRNA Canis familiares (Tab. 1). A expressão gênica foi calculada usando-se o método 2-∆∆CT, e os resultados obtidos para cada grupo foram comparados quantitativamente após a normalização baseada na expressão de gliceraldeído-3-fosfato desidrogenase (GAPDH) Canis familiares. Os níveis de expressão obtidos nas culturas de osteoblastos foram utilizados como controle positivo da diferenciação osteogênica e como padrão de expressão no cálculo da expressão relativa de cada transcripto.
Realizou-se análise de variância (ANOVA), e para cada variável foram determinados a média e o desvio-padrão. As médias foram comparadas pelo teste T de Student, utilizando-se o programa Graphpad Instat 3 (GraphPad Software Inc., USA). Diferenças foram consideradas significativas se P<0,05.
RESULTADOS
As partículas do biovidro 60S apresentaram dissolução parcial após serem adicionadas ao meio de cultivo, causando um aumento significativo na concentração dos íons Si e Ca. A concentração do íon Si foi próxima de zero no meio OST e de 41,28mg/L no meio PI OST. A concentração do íon Ca foi de 87,5mg/L no meio OST e de 156,5mg/L no PI OST, representando uma aumento na ordem de 78,85%.
A suplementação do meio osteogênico com produto iônico (PI OST) aumentou a conversão de MTT em formazan aos 21 dias de cultivo, reduziu aos sete e nenhum efeito foi observado aos 14 (Fig.1). Embora não tenha sido quantificada, verificou-se maior densidade celular nas culturas que receberam o meio PI OST em relação às que receberam o meio OST, aos 14 e 21 dias de cultivo.
Média e desvio-padrão da conversão do MTT em formazan em culturas de CTM-AD caninas mantidas em OST e PI OST por sete, 14 e 21 dias. * (P<0,05).
As CTM-AD mantidas em PI OST mostraram menor atividade da fosfatase alcalina que as mantidas em OST aos 14 e 21 dias de cultivo. Aos sete, nenhuma diferença estatística foi observada (Fig. 2).
Média e desvio-padrão da atividade da fosfatase alcalina em culturas de CTM-AD caninas mantidas em OST e PI OST por sete, 14 e 21 dias. * (P<0,05).
A suplementação do meio osteogênico com produto iônico (PI OST) reduziu a síntese de colágeno aos sete e 21 dias de cultivo, e nenhum efeito foi observado aos 14 dias (Fig. 3).
Média e desvio-padrão do colágeno em culturas de CTM-AD caninas mantidas em OST e PI OST por sete, 14 e 21 dias. * (P<0,05).
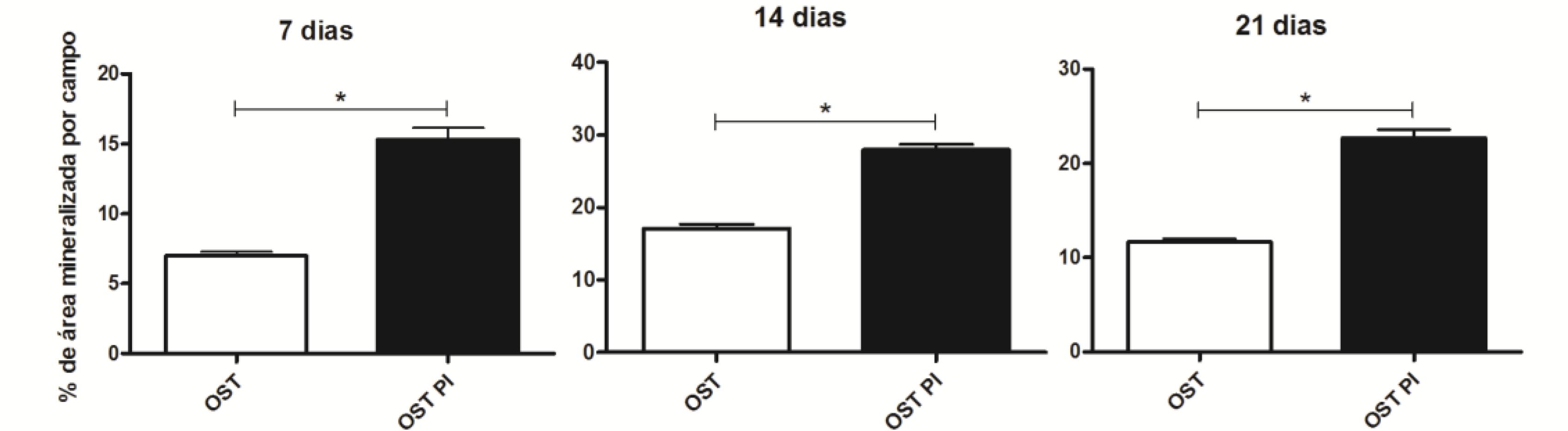
As CTM-AD mantidas em OST e PI OST formaram nódulos de mineralização em todos os tempos estudados (Fig. 4 e 5). A área mineralizada por campo aumentou com o tempo de cultivo nas culturas mantidas em ambos os meios. Verificou-se maior área mineralizada por campo nas culturas de CTM-AD mantidas em PI OST, em relação às mantidas em OST, em todos os tempos estudados (Fig. 4 e 5).
Cultura de CTM-AD caninas mantidas em OST (1) e PI OST (2) por sete (A), 14 (B) e 21 (C) dias. Observar os nódulos de mineralização corados pela técnica de von Kossa. O grupo PI OST (2) mostrou maior área de mineralização em relação ao OST (1). Barra = 350µm
Média e desvio-padrão da área de mineralização por campo em culturas de CTM-AD caninas mantidas em OST e PI OST por sete, 14 e 21 dias. * (P<0,05).
As CTM-AD mantidas em OST e em PI OST mostraram expressão de osterix semelhante e superior à expressão osteoblástica, em todos os tempos estudados (Fig. 6).
Média e desvio-padrão da quantificação relativa do transcrito gênico para osterix pela técnica de RT-PCR em tempo real em culturas CTM-AD caninas mantidas em OST e PI OST aos sete, 14 e 21 dias de cultivo. Os dados estão expressos em relação ao osteoblasto (linha tracejada). * (P<0,05).
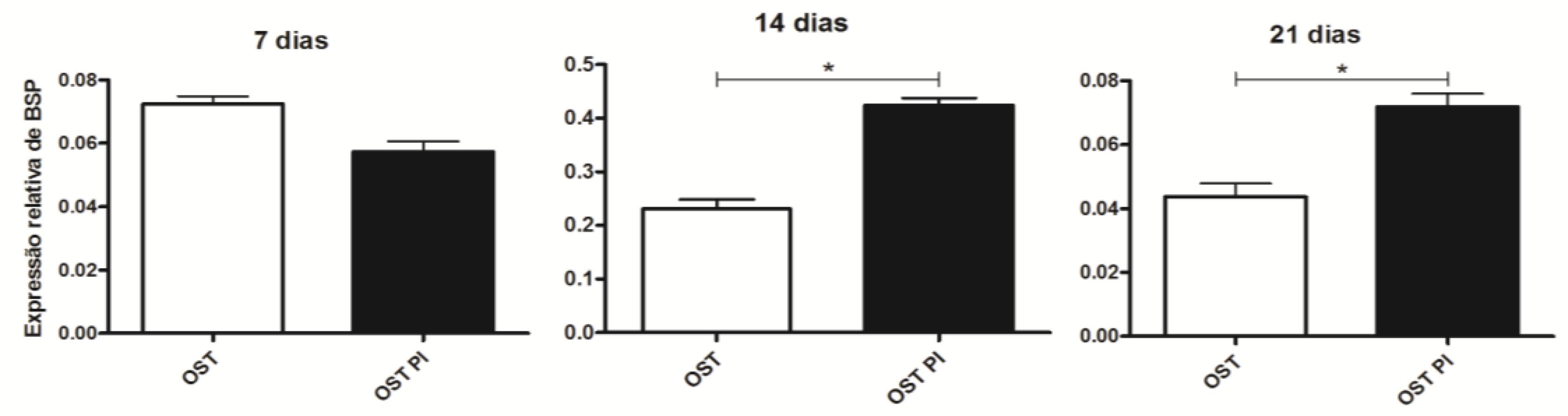
As culturas de CTM-AD mantidas em meio PI OST mostraram maior expressão de sialoproteína óssea que as mantidas em OST, aos 14 e 21 dias. Nenhuma diferença foi observada aos sete dias. Independentemente do meio de cultura utilizado, as CTM-AD mostraram níveis de expressão sialoproteína óssea inferiores aos de osteoblastos, em todos os tempos estudados (Fig. 7).
Média e desvio-padrão da quantificação relativa do transcrito gênico para BSP pela técnica de RT-PCR em tempo real em culturas CTM-AD caninas mantidas em OST e PI OST aos sete, 14 e 21 dias de cultivo. Os dados estão expressos em relação ao osteoblasto (linha tracejada). * (P<0,05).
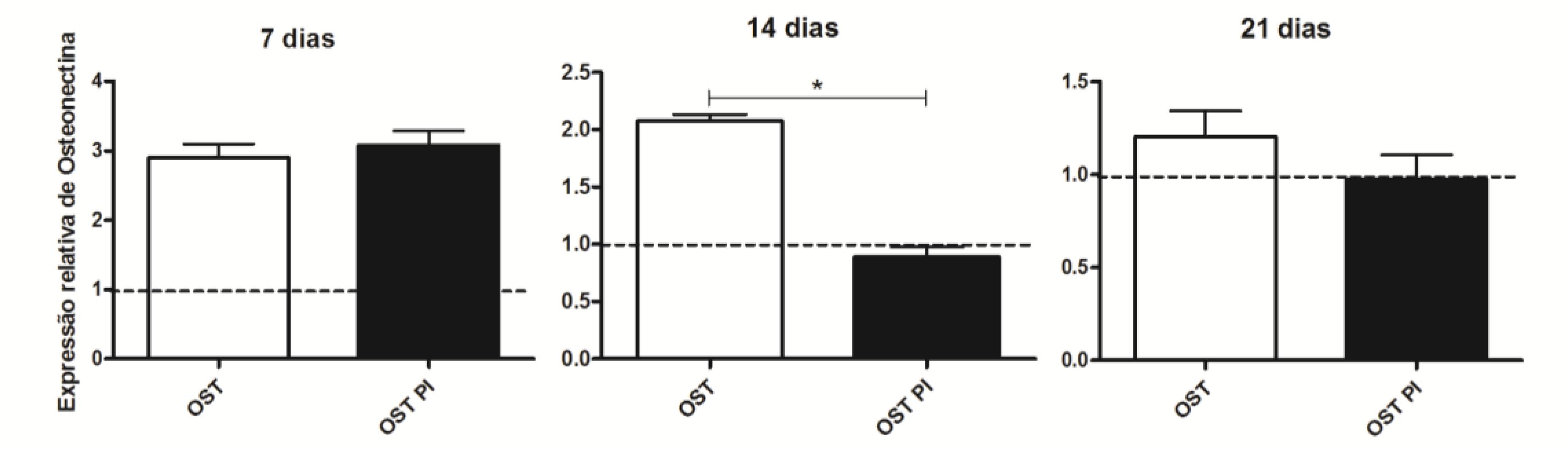
Verificou-se menor expressão de osteonectina nas culturas de CTM-AD mantidas em PI OST em relação às mantidas em OST, aos 14 dias de cultivo, mas nenhuma diferença significativa foi observada nos demais tempos avaliados (Fig.8).
Média e desvio-padrão da quantificação relativa do transcrito gênico para ON pela técnica de RT-PCR em tempo real em culturas CTM-AD caninas mantidas em OST e PI OST aos sete, 14 e 21 dias de cultivo. Os dados estão expressos em relação ao osteoblasto (linha tracejada). * (P<0,05).
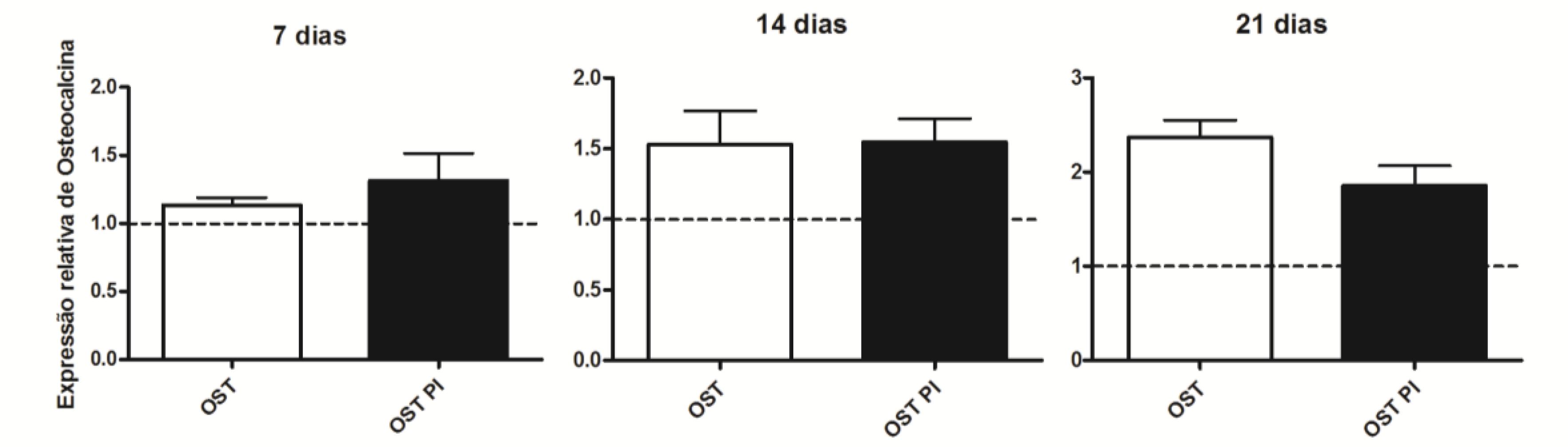
As CTM-AD mantidas em OST e PI OST não mostraram diferenças significativas na expressão de osteocalcina em nenhum dos tempos estudados (Fig. 9).
Média e desvio-padrão da quantificação relativa do transcrito gênico para OC pela técnica de RT-PCR em tempo real em culturas CTM-AD caninas mantidas em OST e PI OST aos sete, 14 e 21 dias de cultivo. Os dados estão expressos em relação ao osteoblasto (linha tracejada). * (P<0,05).
DISCUSSÃO
O aumento na concentração do íon Si até 41,28ppm decorrente da dissolução do biovidro 60S era esperado e foi semelhante a um estudo prévio que utilizou esse mesmo biomaterial em culturas de osteoblastos de rato (Valério et al., 2004VALÉRIO, P.; PEREIRA, M.M.; GOES, A.M. et al. The effect of ionic products from bioactive glass dissolution on osteoblast proliferation and collagen production. Biomaterials, v.25, p.2941-2948, 2004.). Entretanto, esse aumento foi inferior ao observado em outros ensaios com biovidros produzidos pela rota sol-gel (50,2 a 203,11ppm) (Bielby et al., 2004BIELBY, R.C.; CHRISTODOULOU, I.S.; PRICE, R.S. Time and concentration dependent effect of dissolution products of 58S sol-gel bioactive glass on proliferation and differentiation of murine and human osteoblast. Tissue Eng , v.10, p.1018-1026, 2004.; Christodoulou et al., 2006CHRISTODOULOU, I.; BUTTERY, L.D.; TAI, G. et al. Characterization of human fetal osteoblast by microarray analysis following stimulation with 58S bioactive Gel-Glass ionic dissolution products. J. Biomed. Mater. Res. B. Appl. Biomater., v.77, p.431-446, 2006.). Essa variação pode ser explicada pela diferença de composição química entre esses biomateriais e também pela diferença na organização das moléculas, a qual pode determinar maior ou menor dissolução do material quando exposto ao meio aquoso (Pereira et al., 2005PEREIRA, M.M.; JONES, J.R.; OREFICE, R.L.; et al. Preparation of bioactive glass-polyvinil alcohol hybrid foams by the sol-gel method. J Mater Sci Mater Med., v.16, p.1045-1050, 2005.). De forma semelhante, o aumento na concentração do íon Ca até a 156,5ppm decorrente da dissolução do biovidro 60S era também esperado, mas foi superior ao observado em estudo prévio com esse biomaterial em osteoblasto de ratos (Valério et al., 2004VALÉRIO, P.; PEREIRA, M.M.; GOES, A.M. et al. The effect of ionic products from bioactive glass dissolution on osteoblast proliferation and collagen production. Biomaterials, v.25, p.2941-2948, 2004.) e ao observado em outros ensaios com biovidros produzidos pela rota sol-gel (47,06 a 95,8ppm) (Bielby et al., 2004BIELBY, R.C.; CHRISTODOULOU, I.S.; PRICE, R.S. Time and concentration dependent effect of dissolution products of 58S sol-gel bioactive glass on proliferation and differentiation of murine and human osteoblast. Tissue Eng , v.10, p.1018-1026, 2004.; Christodoulou et al., 2006CHRISTODOULOU, I.; BUTTERY, L.D.; TAI, G. et al. Characterization of human fetal osteoblast by microarray analysis following stimulation with 58S bioactive Gel-Glass ionic dissolution products. J. Biomed. Mater. Res. B. Appl. Biomater., v.77, p.431-446, 2006.). Isto implica que o mesmo tipo de biomaterial pode fornecer diferentes resultados segundo sua composição específica e grau de organização das moléculas, o que justifica as diferentes respostas encontradas na literatura.
O aumento da conversão de MTT em cristais de formazan nas CTM-AD mantidas emPI OST em relação às mantidas em OST, aos 21 dias de cultivo (Fig. 1), mostra que os níveis de silício (41,28ppm) e cálcio (41,28ppm) observados no presente estudo são seguros para as CTM-AD de cães. Um estudo recente com cultura de osteoblastos mostrou que a concentração de silício é tóxica para essas células a partir da concentração de 169,35ppm, quando ocorre redução da viabilidade celular e aumento da apoptose (Shie et al., 2011SHIE, M.Y.; DING, S.J.; CHANG, H.C. The role of silicon in osteoblast-like cell proliferation and apoptosis. Acta Biomater., v.7, p.2604-2614, 2011.). No presente estudo, a concentração de silício (41,28ppm) permaneceu bem abaixo dos níveis tóxicos relatados por Shie et al. (2011)SHIE, M.Y.; DING, S.J.; CHANG, H.C. The role of silicon in osteoblast-like cell proliferation and apoptosis. Acta Biomater., v.7, p.2604-2614, 2011.. Quanto ao cálcio, vários estudos já avaliaram seu efeito na viabilidade celular e mostraram que os níveis de cálcio extracelular não devem ultrapassar a concentração de 312,60ppm em cultura de CTM-MO humanas (Barradas et al., 2012BARRADAS, A.M.C.; FERNANDES, H.A.M.; GROEN, N. et al. A calcium-induced signaling cascade leading to osteogenic differentiation of human bone marrow-derived mesenchymal stromal cells. Biomaterials, v.33, p.3205-3215, 2012.) e de 641,24ppm em culturas de CTM-AD humanas (McCullen et al., 2010MCCULLEN, S.D.; ZHAN, J.; ONORATO, M.L. et al. Effect of varied ionic calcium on human adipose-derived stem cell mineralization. Tissue Eng A, v.16, p.1971-1981, 2010.). Embora os níveis de cálcio liberados pelo biovidro 60S (156,5ppm) sejam superiores aos liberados por outros biomateriais semelhantes, eles estão muito abaixo dos níveis considerados tóxicos.
O maior valor no teste do MTT verificado aos 21 dias foi observado nas CTM-AD mantidas em PI OST (Fig. 1), o que sugere que os íons liberados pelo biovidro 60S favorecem a atividade dessas culturas por aumentarem a atividade mitocondrial e/ou o número de células na cultura, o que de fato foi observado no presente estudo, embora não tenha sido quantificado. Tanto o aumento do número de células quanto o aumento da atividade de cada uma delas favorecem a produção de matriz extracelular, o que é uma vantagem para a regeneração óssea.
O significativo aumento da área mineralizada (Fig. 6) observado nas culturas que receberam o produto iônico mostra que os íons liberados na dissolução do biovidro 60S favorecem a osteogênese in vitro e leva a crer que esse biomaterial possa apresentar resultado semelhante também in vivo. Sabe-se que o produto de dissolução de algumas biocerâmicas pode favorecer a proliferação (Tsigkou et al., 2009TSIGKOU, O.; JONES, J.R.; POLAK, J.M. et al. Differentiation of fetal osteoblasts and formation of mineralized bone nodules by 45S5 Bioglass conditioned medium in the absence of osteogenic supplements. Biomaterials, v.30, p.3542-3550, 2009.) e a diferenciação osteogênica (Jung e Park, 2010JUNG, G.Y.; PARK, Y.J. Effects of HA released calcium ion on osteoblast differentiation. J Mater Sci: Mater Med, v.21, p.1649-1654, 2010.), bem como a osteogênese in vitro (Tsigkou et al., 2009TSIGKOU, O.; JONES, J.R.; POLAK, J.M. et al. Differentiation of fetal osteoblasts and formation of mineralized bone nodules by 45S5 Bioglass conditioned medium in the absence of osteogenic supplements. Biomaterials, v.30, p.3542-3550, 2009.), mas o presente estudo parece ser o primeiro a demonstrar os efeitos benéficos do produto iônico do biovidro 60S na diferenciação osteogênica de CTM-AD de cães. Esses efeitos benéficos são atribuídos principalmente aos íons silício e cálcio, liberados durante o processo de dissolução dos biovidros (Shie et al., 2011SHIE, M.Y.; DING, S.J.; CHANG, H.C. The role of silicon in osteoblast-like cell proliferation and apoptosis. Acta Biomater., v.7, p.2604-2614, 2011.; Varanasi et al., 2012VARANASI, V.G.; LEONG, K.K.; DOMINIA, L.M. et al. Si e Ca individually and combinatorially target enhanced MC3T3-E1 subclone 4 early osteogenic marker expression. J. Oral Implantol., v.38, p.325-336, 2012.). Estudos com cultivo de osteoblastos de rato já mostraram que o silício é capaz de aumentar a atividade e a proliferação celular (Shie et al., 2011SHIE, M.Y.; DING, S.J.; CHANG, H.C. The role of silicon in osteoblast-like cell proliferation and apoptosis. Acta Biomater., v.7, p.2604-2614, 2011.), a expressão de genes ligados à diferenciação osteogênica (Varanasi et al., 2012VARANASI, V.G.; LEONG, K.K.; DOMINIA, L.M. et al. Si e Ca individually and combinatorially target enhanced MC3T3-E1 subclone 4 early osteogenic marker expression. J. Oral Implantol., v.38, p.325-336, 2012.) e de favorecer a mineralização da matriz extracelular (Shie et al., 2011SHIE, M.Y.; DING, S.J.; CHANG, H.C. The role of silicon in osteoblast-like cell proliferation and apoptosis. Acta Biomater., v.7, p.2604-2614, 2011.). Sabe-se também que o cálcio extracelular é capaz de aumentar a atividade e a proliferação celular em culturas de CTM-MO (Barradas et al., 2012BARRADAS, A.M.C.; FERNANDES, H.A.M.; GROEN, N. et al. A calcium-induced signaling cascade leading to osteogenic differentiation of human bone marrow-derived mesenchymal stromal cells. Biomaterials, v.33, p.3205-3215, 2012. e CTM-AD de humanos (McCullen et al., 2010MCCULLEN, S.D.; ZHAN, J.; ONORATO, M.L. et al. Effect of varied ionic calcium on human adipose-derived stem cell mineralization. Tissue Eng A, v.16, p.1971-1981, 2010.). Já foi também demonstrado que o cálcio extracelular é capaz de aumentar a expressão de genes relacionados à diferenciação osteogênica de osteoblastos de roedores (Jung e Park, 2010JUNG, G.Y.; PARK, Y.J. Effects of HA released calcium ion on osteoblast differentiation. J Mater Sci: Mater Med, v.21, p.1649-1654, 2010.) e de CTM-MO humanas (Barradas et al., 2010BARRADAS, A.M.C.; FERNANDES, H.A.M.; GROEN, N. et al. A calcium-induced signaling cascade leading to osteogenic differentiation of human bone marrow-derived mesenchymal stromal cells. Biomaterials, v.33, p.3205-3215, 2012.), bem como de favorecer a síntese e a mineralização da matriz extracelular CTM-AD humanas diferenciadas (McCullen et al., 2010MCCULLEN, S.D.; ZHAN, J.; ONORATO, M.L. et al. Effect of varied ionic calcium on human adipose-derived stem cell mineralization. Tissue Eng A, v.16, p.1971-1981, 2010.). Os estudos previamente citados mostram que o cálcio é capaz de favorecer a diferenciação osteogênica e a osteogênese in vitro, mas pouco se conhece a respeito dos mecanismos envolvidos. Já foi comprovado que o aumento de cálcio extracelular é capaz de aumentar as expressões de osteopontina (OPN) e osteonectina (BSP) em osteoblastos de rato e que esse efeito é mediado pelos canais de cálcio tipo-L (L-type Calcium Channel) e pela via de sinalização calcium/calmodulin-dependente da protein kinase 2 (CaM-CaMK2)(Jung e Park, 2010JUNG, G.Y.; PARK, Y.J. Effects of HA released calcium ion on osteoblast differentiation. J Mater Sci: Mater Med, v.21, p.1649-1654, 2010.). Muito embora o produto iônico do biovidro 60S tenha reduzido a síntese de colágeno, aos sete e 21 dias (Fig. 4), e a atividade da FA, aos 14 e 21 dias de cultivo (Fig. 3), isso não interferiu na síntese e mineralização da matriz extracelular pelas CTM-AD de cães (Fig. 5 e 6). Estudos com culturas de osteoblastos de ratos (Valério et al., 2004VALÉRIO, P.; PEREIRA, M.M.; GOES, A.M. et al. The effect of ionic products from bioactive glass dissolution on osteoblast proliferation and collagen production. Biomaterials, v.25, p.2941-2948, 2004.) e de humanos (Tsigkou et al., 2009TSIGKOU, O.; JONES, J.R.; POLAK, J.M. et al. Differentiation of fetal osteoblasts and formation of mineralized bone nodules by 45S5 Bioglass conditioned medium in the absence of osteogenic supplements. Biomaterials, v.30, p.3542-3550, 2009.) mostraram efeito estimulatório do biovidro na síntese de colágeno (Valério et al., 2004VALÉRIO, P.; PEREIRA, M.M.; GOES, A.M. et al. The effect of ionic products from bioactive glass dissolution on osteoblast proliferation and collagen production. Biomaterials, v.25, p.2941-2948, 2004.) e na atividade da fosfatase alcalina (Tsigkou et al., 2009TSIGKOU, O.; JONES, J.R.; POLAK, J.M. et al. Differentiation of fetal osteoblasts and formation of mineralized bone nodules by 45S5 Bioglass conditioned medium in the absence of osteogenic supplements. Biomaterials, v.30, p.3542-3550, 2009.). No entanto, esses estudos trabalharam com espécie e tipo celular diferentes dos utilizados no presente estudo, o que pode justificar a diferença de resposta observada.
A maior expressão de sialoproteina óssea e a maior área mineralizada por campo observadas nas CTM-AD mantidas em PI OST em relação às mantidas em OST (Fig.8) mostram que o produto iônico do biovidro 60S favorece a osteogênese in vitro.Sugerem também que esse aumento na osteogênese seja mediado pelo aumento da expressão da sialoproteína óssea. A BSP é uma das proteínas responsáveis pelo início do processo de nucleação e deposição de hidroxiapatita na matriz óssea. O aumento na sua expressão reflete a fase final de diferenciação e o início de mineralização da matriz. A sialoproteina óssea pode ser expressa por pré-osteoblastos e osteoblastos (Zhou et al., 2006ZHOU, Y.S.; LIU, Y.S.; JIAN-GUO, T. Is 1,25-dihydroxyvitamin D3 an ideal substitute for dexamethasone for inducing osteogenic differentiation of human adipose tissue-derived stromal cells in vitro?. Chin. Med. J., v.119, p.1278-1286, 2006.).
A insignificante variação na expressão de osterix (Fig. 7), osteonectina (Fig. 9) e osteocalcina (Fig. 10), observada nas CTM-AD que receberam o produto iônico, sugere que o efeito do produto de dissolução do biovidro 60S não é mediado pelas expressões dessas proteínas. O osterix é um fator de transcrição imprescindível no processo de diferenciação osteogênica e atua na transformação dos pré-osteoblastos em osteoblastos maduros, finalizando, assim, o processo de diferenciação osteogênica (Long, 2012LONG, F. Building strong bones: molecular regulation of the osteoblast lineage. Nat Rev Mol Cell Biol, v.13, p.27-38, 2012.). A osteonectina e a osteocalcina são proteínas não colagênicas da matriz e estão intimamente relacionadas com o processo de síntese e mineralização da matriz óssea e com o estágio final de diferenciação osteogênica (Nakashima et al., 2002NAKASHIMA, K.; ZHOU, X.; KUNKEL, G. et al. The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiations and bone formation. Cell, v.108, p.17-29, 2002.).
CONCLUSÃO
O produto iônico do biovidro 60S favorece a osteogênese in vitro de culturas de CTM-AD de cães com aumento da conversão de MTT, da área mineralizada por campo e da expressão de sialoproteína óssea.
AGRADECIMENTOS
Os autores agradecem à Fapemig, pelo financiamento do projeto de pesquisa; ao CNPq, pela bolsa de estudo de doutorado; à Escola de Veterinária, ao Laboratório de Biologia Molecular do Departamento de Imunologia e Bioquímica do Instituto de Ciências Biológicas e ao Laboratório de Biomateriais do Departamento de Engenharia Metalúrgica e de Materiais da UFMG, pelo suporte necessário para completar o presente estudo.
REFERÊNCIAS
- BARRADAS, A.M.C.; FERNANDES, H.A.M.; GROEN, N. et al. A calcium-induced signaling cascade leading to osteogenic differentiation of human bone marrow-derived mesenchymal stromal cells. Biomaterials, v.33, p.3205-3215, 2012.
- BIELBY, R.C.; CHRISTODOULOU, I.S.; PRICE, R.S. Time and concentration dependent effect of dissolution products of 58S sol-gel bioactive glass on proliferation and differentiation of murine and human osteoblast. Tissue Eng , v.10, p.1018-1026, 2004.
- CHRISTODOULOU, I.; BUTTERY, L.D.; TAI, G. et al. Characterization of human fetal osteoblast by microarray analysis following stimulation with 58S bioactive Gel-Glass ionic dissolution products. J. Biomed. Mater. Res. B. Appl. Biomater., v.77, p.431-446, 2006.
- HOPPE, A.; GULDAL, N.S.; BOCCACCINI, A.R. A review of the biological response to ionic products from bioactive glasses and glass-ceramics. Biomaterials, v.32, p.2757-2774, 2011.
- JUNG, G.Y.; PARK, Y.J. Effects of HA released calcium ion on osteoblast differentiation. J Mater Sci: Mater Med, v.21, p.1649-1654, 2010.
- LONG, F. Building strong bones: molecular regulation of the osteoblast lineage. Nat Rev Mol Cell Biol, v.13, p.27-38, 2012.
- MCCULLEN, S.D.; ZHAN, J.; ONORATO, M.L. et al. Effect of varied ionic calcium on human adipose-derived stem cell mineralization. Tissue Eng A, v.16, p.1971-1981, 2010.
- NAKASHIMA, K.; ZHOU, X.; KUNKEL, G. et al. The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiations and bone formation. Cell, v.108, p.17-29, 2002.
- NEUPANE, M.; CHANG, C.; KIUPEL, M.; et al. Isolation and characterization of canine adipose-derived mesenquimal stem cells. Tissue Eng. A, v.14, p.1007-1015, 2008.
- PEREIRA, M.M.; JONES, J.R.; OREFICE, R.L.; et al. Preparation of bioactive glass-polyvinil alcohol hybrid foams by the sol-gel method. J Mater Sci Mater Med., v.16, p.1045-1050, 2005.
- QIU, Z.; YANG, H.; WU, J. et al. Ionic dissolution products of NovaBone(r) promote osteoblastic proliferation via influences on the cell cycle. J. Int. Med. Res., v.37, p.737-745, 2009.
- SHIE, M.Y.; DING, S.J.; CHANG, H.C. The role of silicon in osteoblast-like cell proliferation and apoptosis. Acta Biomater., v.7, p.2604-2614, 2011.
- TSIGKOU, O.; JONES, J.R.; POLAK, J.M. et al. Differentiation of fetal osteoblasts and formation of mineralized bone nodules by 45S5 Bioglass conditioned medium in the absence of osteogenic supplements. Biomaterials, v.30, p.3542-3550, 2009.
- VALÉRIO, P.; PEREIRA, M.M.; GOES, A.M. et al. The effect of ionic products from bioactive glass dissolution on osteoblast proliferation and collagen production. Biomaterials, v.25, p.2941-2948, 2004.
- VARANASI, V.G.; LEONG, K.K.; DOMINIA, L.M. et al. Si e Ca individually and combinatorially target enhanced MC3T3-E1 subclone 4 early osteogenic marker expression. J. Oral Implantol., v.38, p.325-336, 2012.
- VIEIRA, N.M.; BRANDALISE, V.; ZUCCONI, E. et al. Isolation, characterization, and differentiation potential of canine adipose-derived stem cells. Cell Transplant., v.19, p.279-289, 2010.
- ZHOU, Y.S.; LIU, Y.S.; JIAN-GUO, T. Is 1,25-dihydroxyvitamin D3 an ideal substitute for dexamethasone for inducing osteogenic differentiation of human adipose tissue-derived stromal cells in vitro?. Chin. Med. J., v.119, p.1278-1286, 2006.
Datas de Publicação
-
Publicação nesta coleção
Jul-Aug 2015
Histórico
-
Recebido
03 Abr 2014 -
Aceito
27 Mar 2015